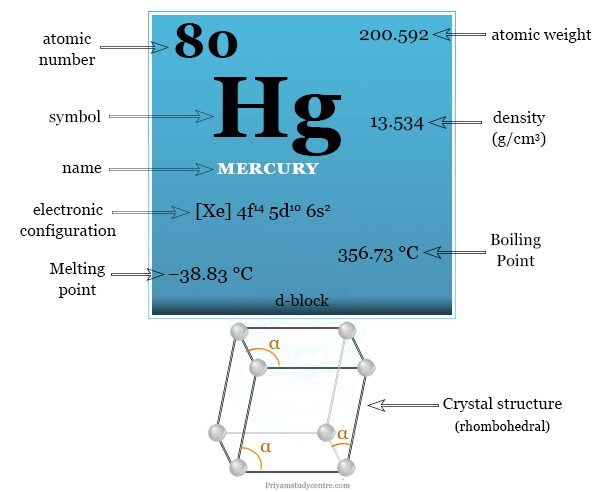
Datos sobre Mercurio
Mercurio es un elemento químico del bloque d de la tabla periódica con el símbolo Hg y número atómico 80. Es un metal líquido gris brillante a temperatura y presión estándar.
Aristóteles llamó plata líquida al mercurio. También se le llamó agua de plata, derivada del nombre latino hydrargyrum.
Lectura relacionada: Paladio, Propiedades, Uso, Hechos, Conexiones
Paladio, Propiedades, Uso, Hechos, ConexionesLos elementos del grupo 12 (IIB) zinc, cadmio y mercurio se encuentran después del cobre, la plata y el oro con configuración de capa de valencia d10s2.
El mercurio, un elemento pesado y plateado del bloque D, se obtiene fácilmente del cinabrio (HgS), que se usa ampliamente como pigmento. El mercurio todavía se usa en gran medida en la celda electroquímica, aunque causa contaminación ambiental. También se utiliza para fabricar termómetros, barómetros, manómetros, tensiómetros, válvulas de flotador, etc.
¿Dónde se encuentra el mercurio?
Es un elemento muy raro que se encuentra en la corteza terrestre, pero el hombre descubrió el mercurio en la antigüedad. Se encuentra más comúnmente en formas nativas o minerales como cinabrio (HgS), metacinabrio, esfalerita, corderoita y livingstonita.
Lectura relacionada: Hafnio, Símbolo, Descubrimiento, Isótopos, Propiedades, Uso
Hafnio, Símbolo, Descubrimiento, Isótopos, Propiedades, UsoLa mayoría de los minerales contienen alrededor del uno por ciento de Hg, pero los minerales de Spin contienen del 12 al 14 por ciento de Hg. Por lo tanto, el espín es el mayor depositante de metal. También se encuentra en niveles muy bajos en la biosfera y en combustibles fósiles como el carbón, el petróleo y el gas natural.
Los principales países productores de mercurio fueron España, Italia, Estados Unidos, México, China, Kirguistán y Argelia.
Debido a la caída de los precios, la mayoría de estos países han dejado de producir mercurio. La producción de mercurio a partir de la minería todavía tiene lugar en varios países, como España, China, Kirguistán y Argelia.
Lectura relacionada: Niobio, Símbolo, Hechos, Propiedades, Uso
Niobio, Símbolo, Hechos, Propiedades, UsoProceso de Extracción
La extracción de mercurio es relativamente simple. El cinabrio molido (HgS) se concentra por flotación.
Se puede obtener calentando HgS en aire (600 °C) seguido de descomposición.
2HgS + 3O2 → 2HgO + 2SO2
2HgO → 2Hg + O2
El mercurio comercial es impuro, pero el metal crudo contiene más metales básicos como plomo, zinc, cobre, hierro, etc.
- Puede purificarse pasando una fina corriente de Hg impuro a través de una columna de ácido nítrico diluido.
- Se produce algo de nitrato espeso de veza (I).
- Reacciona con el metal impuro para producir su nitrato y liberar Hg.
- El proceso se repite varias veces para lograr el nivel de pureza de mercurio deseado.
Una técnica mejor y más utilizada es la destilación de mercurio impuro al vacío.
Propiedades químicas
Un metal blanco plateado pesado, el mercurio ha llenado la subcapa d. Por tanto, se comporta más como un elemento representativo que como un metal de transición.
El estado de oxidación característico del Hg es +2. También formó dimercurio o Hg2+2 con estado de oxidación +1.
| Mercurio |
|||
| Símbolo | Hg | ||
| Descubrimiento | descubierto alrededor del 1500 a.C. | ||
| Origen del nombre | llamado así por el planeta Mercurio | ||
| isótopos principales | 202Hg | ||
| Propiedades periódicas | |||
| número atómico | 80 | ||
| Peso atomico | 200,592 | ||
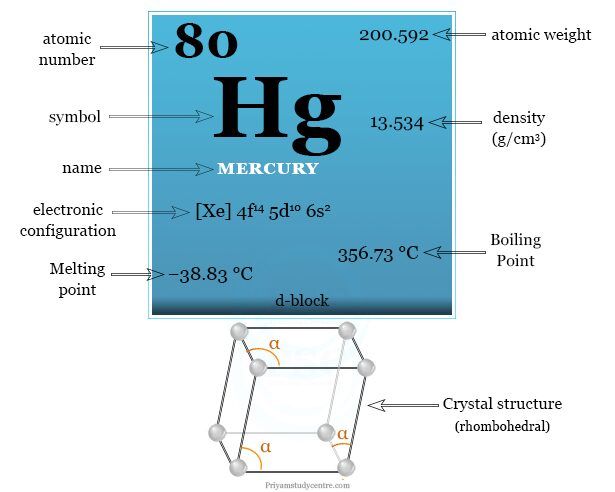
| electrón por escala | 2, 8, 18, 32, 18, 2 | ||
| Configuración electrónica | [Xe] 4f14 5d10 6s2 | ||
| Grupo | 12 | ||
| Período de tiempo | 6 | ||
| Bloquear | bloque d | ||
| Características físicas | |||
| Apariencia | líquido plateado y brillante | ||
| estructura cristalina | romboédrico | ||
| Espesor | 13,534 g/cm3 | ||
| Se mantiene a 20°C | Líquido | ||
| Punto de fusion | −38,8290 °C | ||
| Punto de ebullición | 356,73 ºC | ||
| Temperatura crítica | 1750K | ||
| Propiedades químicas | |||
| Radio atómico, sin consolidar | 2.23 | ||
| Radio covalente | 1.32 | ||
| Número de oxidación común | +1 y +2 | ||
| Capacidad calorífica molar | 27,983 Jmol−1 k−1 | ||
| Afinidad electrónica (kJ mol−1) | Desconocido | ||
| electronegatividad | 2.00 según la escala de Pauling | ||
| Energía de ionización (kJ/mol) | 1º | 2do | 3ro |
| 1007.1 | 1810 | 3300 | |
| número CAS | 7439-97-6 | ||
Configuración electrónica del mercurio
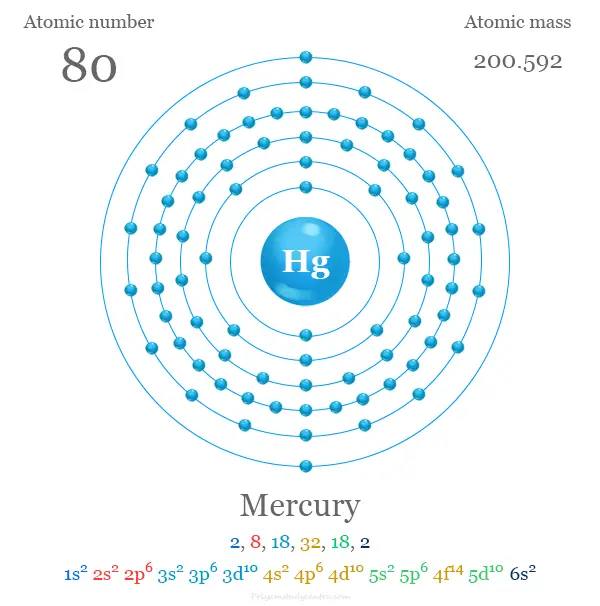
Mercurio en la tabla periódica
Se ubica en el grupo 12 y período 6 de la tabla periódica con configuración electrónica de capa de valencia 4f14 5d10 6s2. Es un metal de bloque D que se coloca junto con zinc y cadmio.
compuestos de mercurio
La principal diferencia entre la primera y la segunda energía de ionización sugiere que el mercurio formó compuestos químicos en los estados de oxidación +1 y +2. Un estado univalente de Hg aparece en forma de Hg2+2.
El estudio de la química del mercurio está incompleto sin una apreciación de los equilibrios de Hg(I) y Hg(II). Los potenciales redox de diferentes pares se dan debajo de la tabla,
| reacción de equilibrio | Potencial redox (voltios) |
| Hg2+2 + 2º → 2Hg | +0.789 |
| 2Hg+2 + 2º → Hg2+2 | 0.920 |
| Hg+2 + 2º → Hg | +0.854 |
| Hg2+2 → Hg + Hg+2 | +0.131 |
De la tabla anterior, solo aquellos oxidantes que tienen un potencial redox dentro del rango de +0.789 a +0.854 voltios pueden oxidar el mercurio metálico a un estado de mercurio espeso (I).
Desde un punto de vista práctico, no podemos encontrar un agente oxidante cuyo potencial esté en el rango de +0.789 a +0.854. Por lo tanto, la oxidación directa de Hg al estado de dimercurio (I) no es posible. La mayoría de los compuestos químicos se forman en el estado Hg(II).
Óxido de mercurio (II)
El óxido de mercurio (II) es un compuesto químico de color rojo o amarillo según el tamaño de las partículas.
- La forma roja se obtiene calentando lentamente Hg en oxígeno hasta unos 350°C. También se obtiene calentando Hg(NO.)3)2.
- Se obtiene una forma amarilla de HgO agregando álcali a la solución de Hg(II).
El óxido, HgO, es débilmente básico y se disuelve en ácidos para formar sales.
Sulfuro de mercurio (II)
El sulfuro de mercurio(II) se precipita como un material negro cuando se pasa sulfuro de hidrógeno a través de una solución de sales de Hg(II). También se obtiene moliendo mercurio metálico con azufre.
Se obtiene en una variedad roja y negra. La variedad roja estable es un pigmento precioso. El sulfuro es muy insoluble y puede disolverse hirviéndolo con agua regia.
Cloruro, bromuro y yoduro
El sublimado blanco de cloruro de mercurio se obtiene calentando mercurio metálico en cloro o calentando una mezcla seca de sulfato de mercurio con cloruro de sodio.
Cuando se hierve con una solución de amoníaco, se forma un precipitado blanco infusible de Hg (NH .).2)Cl que se hidroliza para dar la base de Millon. Reacciona con amoníaco gaseoso para formar un precipitado blanco fusible de HgCl. Dar forma22NH3.
El bromuro y el yoduro de mercurio (II) se obtienen mediante la adición de iones de bromo o yodo a una solución de cloruro de Hg (II).
La solubilidad de los haluros en solución acuosa disminuye del orden del HgF2 > HgCl2 > HgBr2 > HgI2.
Nitrato y Sulfato
El nitrato y el sulfato de mercurio (II) se obtienen por la acción del ácido nítrico o sulfúrico sobre el Hg metálico.
Estos son solubles en agua y estables en presencia de ácidos.
6 Hg + 8 HNO3 → 3 Hg2(NO3)2 + 4 horas2O + 2 NO
3 Hg2(NO3)2 + 8 HNO3 → 6 Hg (SIN3) 2 + 2 NA + 4 H2O
2Hg + 2H2ASI QUE4 → Hg2ASI QUE4 + SO2 + 2H2O
¿Para qué se usa el mercurio?
El mercurio elemental se conocía en la antigua India, China, Egipto y Grecia. El Ayurveda indio describe el proceso de extracción de mercurio puro de su mineral cinabrio. Lo usaban principalmente para medicamentos y cosméticos.
Hoy en día, el uso de mercurio se está reduciendo debido a su efecto tóxico sobre el medio ambiente y la salud humana.
- Todavía se usa mucho en celdas electrolíticas para la producción de soda cáustica (NaOH) y cloro gaseoso.
- El mercurio líquido se utiliza en un electrodo de referencia secundario, como un electrodo de calomelanos en electroquímica. Se utiliza para calcular el potencial de la celda.
- Se utiliza en las industrias eléctrica y electrónica para fabricar rectificadores de CA y lámparas de vapor de Hg.
- En el laboratorio, es ampliamente utilizado para fabricar termómetros, barómetros, manómetros, tensiómetros, válvulas de flotador, etc.
- Los compuestos como el acetato de fenilmercurio (II) y otros compuestos orgánicos de mercurio se han utilizado como fungicidas y germicidas.
- El proceso de fusión se utiliza para la extracción de metales preciosos como la plata y el oro. Se reemplaza gradualmente por el proceso de cianuro.
- El mercurio líquido se utiliza como refrigerante en algunos reactores nucleares.
¿Cuánto mercurio es venenoso?
Es tóxico debido a su baja presión de vapor y entra fácilmente en nuestro cuerpo a menos que se tomen precauciones.
Causa varios tipos de enfermedades como tumores, dolores de cabeza, cistitis, pérdida de memoria y otros trastornos cerebrales.
Alfred Stock fue víctima de tal envenenamiento por mercurio mientras manejaba constantemente bombas de vacío en relación con su investigación sobre el boro y el hidruro de silicio.
Efectos del mercurio en el medio ambiente
El mercurio elemental ingresa a las aguas residuales a través de varios tipos de industrias y afecta nuestro medio ambiente de diferentes maneras.
Se convierte en especies como CH3Hg y (CH3) 2Hg por bacterias anaerobias sintetizadoras de metano. La conversión es facilitada por Co(III) en vitamina B12.
Estas especies ingresan al plancton a través de los peces y luego ingresan a nuestra cadena alimentaria. El mercurio orgánico también ingresa a las aguas residuales ya nuestra cadena alimenticia a través de pesticidas y fungicidas.
El catión metilmercurio proviene de la cadena alimentaria unida a las membranas celulares y tejidos cerebrales. Mantienen su posición durante un largo período de tiempo.
Puede ser habitado por la función normal del cerebro. Nivel de CH de 0,5 ppm3Hg+ en la sangre es suficiente para interrumpir la función fisiológica normal.
El contenido normal de mercurio en el agua es de 0,001 a 0,0001 ppm, pero las aguas residuales de las aguas residuales elevan este nivel a 10 veces más. Finalmente convertido a CH3Hg+ y entrar en nuestra cadena alimenticia provocando una tragedia como la de Minamata.
El informe más trágico de envenenamiento por mercurio vino de Irak en 1972, donde 450 personas murieron después de consumir pesticidas Hg que contenían trigo.