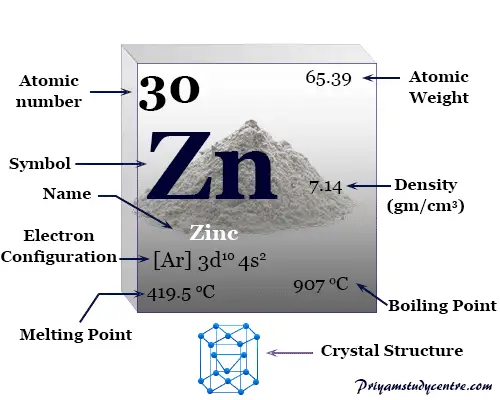
¿Qué es el zinc metálico?
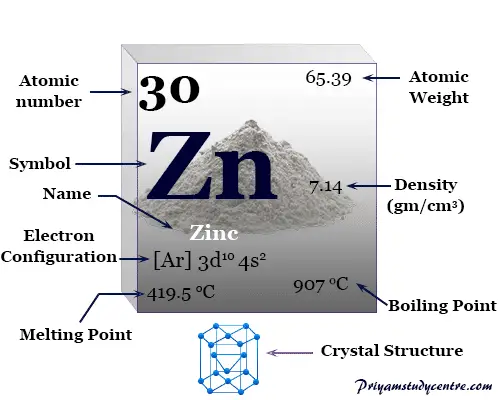
Zinc es un elemento químico o metal plateado brillante del grupo 12 o IIB de la tabla periódica con número atómico 30 y símbolo Zn. Se utiliza principalmente para fabricar aleaciones, recubrimientos resistentes a la corrosión y celdas electroquímicas o celdas secas.
Del grupo de 12 elementos de la tabla periódica, solo el mercurio forma un número limitado de compuestos en el estado o número de oxidación +1, pero otros elementos como Zn y Cd forman los compuestos químicos en el estado +2.
Lectura relacionada: Cobalto, Símbolo, Historia, Propiedades, Hechos, Uso
Cobalto, Símbolo, Historia, Propiedades, Hechos, UsoLa aparición de electrones protectores a lo largo del orbital 3D hace que el electrón d forme parte del núcleo interno del átomo de zinc. Por lo tanto, solo deja electrones s para el enlace químico.
¿Dónde se encuentra el zinc?
Es más abundante (76 ppm) en la corteza terrestre que el cobre (68 ppm). Mezcla de zinc (ZnS) y calamina (ZnCO3) son los minerales metálicos más comunes. Los otros minerales importantes menores son la franklinita (ZnO, Fe2O3) y willemita (Zn2SiO4).
Se encuentra más comúnmente en Canadá, países rusos, Australia, China, Perú y los Estados Unidos.
Lectura relacionada: Acero, Especies, Composición, Uso, Propiedades, Producción
Acero, Especies, Composición, Uso, Propiedades, ProducciónLa fabricación de latón a partir de minerales de cobre y zinc ya se conocía en la antigüedad en Palestina, Grecia, Roma, India y China. La extracción del metal era difícil en este momento.
El nombre zinc puede estar relacionado con la palabra alemana Zinke que significa uña o diente. El nombre también proviene de la palabra latina leucoma o deslustre blanco.
Propiedades del zinc
El zinc tiene una red cristalina hexagonal cerrada con distancias alargadas entre capas que hacen que el metal sea más denso que el cobre y la plata.
Lectura relacionada: Escandio, Símbolo, Propiedades, Hechos, Uso
Escandio, Símbolo, Propiedades, Hechos, UsoEl bajo punto de fusión y ebullición del metal refleja la débil participación del electrón ns externo para la unión del metal.
Algunas propiedades físicas y atómicas del zinc se dan debajo de la tabla,
| Zinc | |||
| Símbolo | zn | ||
| Descubrimiento | Andreas Marggraf | ||
| Nombre derivado de | La palabra alemana Zinke significa espiga o diente y la palabra latina leucoma o depósito blanco | ||
| isótopo común | 30zn64 | ||
| Estado de oxidación común: | +2 | ||
| número CAS | 7440-66-6 | ||
| Propiedades periódicas | |||
| número atómico | 30 | ||
| Masa atómica relativa | 65.38 | ||
| electrón por celda | 2, 8, 18, 2 | ||
| Configuración electrónica | [Ar] 3d10 4s2 | ||
| Bloquear | bloque d | ||
| Grupo | 12 | ||
| Período de tiempo | 4 | ||
| Características físicas | |||
| Condición a 20 °C | firma | ||
| Punto de fusion | 419,53 °C, 787,15 °F, 692,68 K | ||
| Punto de ebullición | 907°C, 1665°F, 1180K | ||
| Capacidad calorífica molar | 25.470 J mol−1 k1 | ||
| estructura cristalina | empaquetado herméticamente hexagonal (hcp) | ||
| Espesor | 7,134 g/cm3 | ||
| Resistencia eléctrica | 59,0 nanómetro | ||
| Propiedades atómicas | |||
| Radio atómico (sin consolidar) | 2.01 | ||
| Radio covalente | 1.20 | ||
| electronegatividad | 1,65 (escala de Pauling) | ||
| Afinidad electronica | desconocido | ||
| Energía de ionización (kJ/mol) | 1º | 2do | 3ro |
| 906.40 | 1733.30 | 3832.69 | |
Zinc en la tabla periódica
Se coloca en el grupo-12 y el período-4 en la tabla periódica con los miembros del grupo de mercurio y cadmio. Zn es el último miembro de los elementos de bloque 3D.
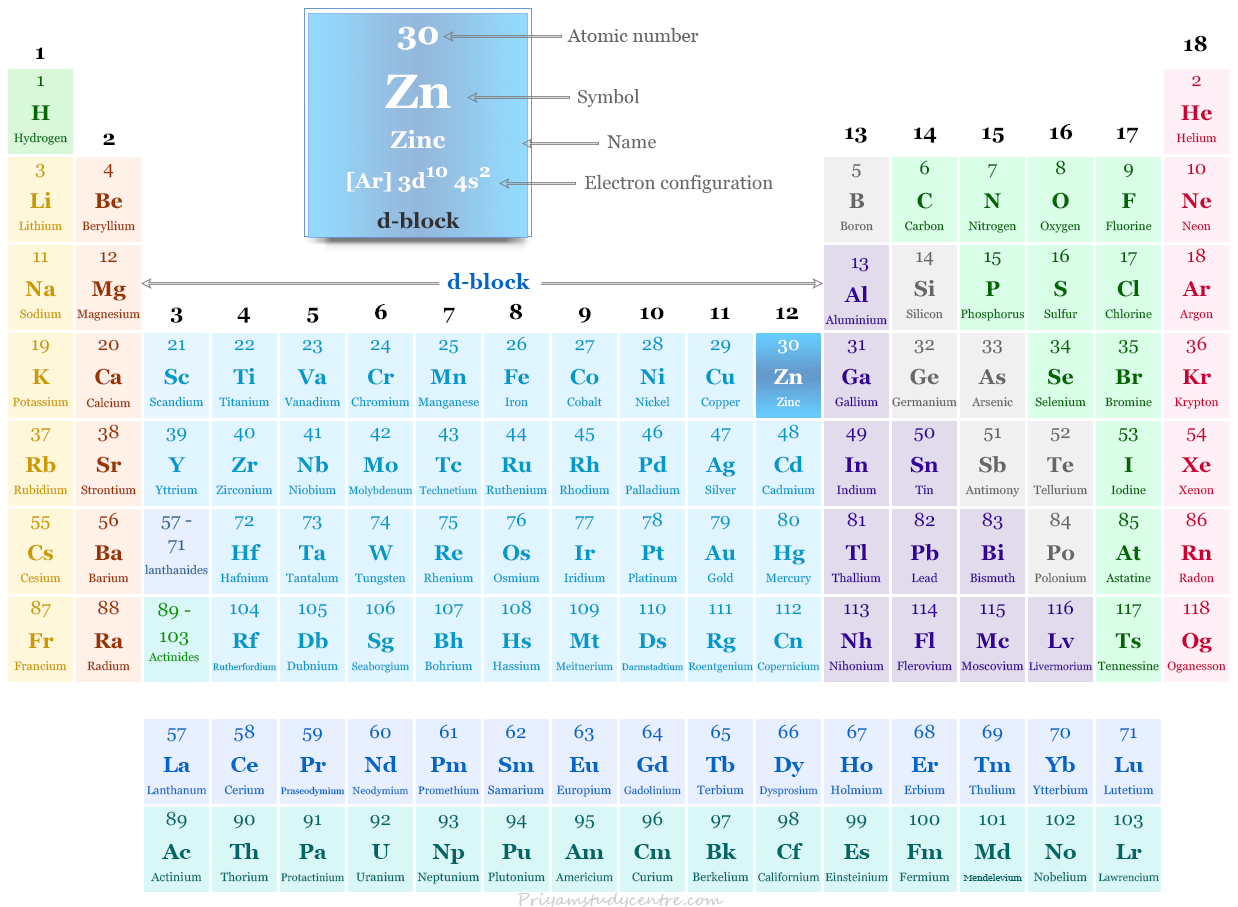
No es parte del metal de transición según la definición de metales de transición. Pero debido a sus propiedades similares y para mantener una clasificación racional, el zinc generalmente se estudia con metales de transición.
Producción de zinc
A diferencia del hierro, la reducción de ZnO por carbón no es un proceso efectivo para la producción de zinc debido a su punto de ebullición (907°C).
Recuperación de zinc por electrólisis
- En el proceso de electrólisis, el mineral se tuesta a menor temperatura (650 ºC) a ZnSO4.
- La masa tostada se extrae con ácido sulfúrico diluido y el extracto se trata con lechada de cal para precipitar hierro, aluminio y sílice.
- A continuación, se precipitan el cobre y el cadmio.
- La solución de ZnSO4 electrólisis a través del ánodo de aluminio y el ánodo de zinc bajo alta corriente para producir el metal puro.
Extracción en alto horno
Actualmente, el metal se extrae mediante un alto horno especialmente diseñado. El mineral se tuesta hasta oxidarse con coque, que se volatiliza con el soplo caliente. El gas se enfría repentinamente vertiendo plomo fundido sobre él. Por lo tanto, la reoxidación de zinc durante el enfriamiento se vuelve insignificante.
La forma líquida de zinc metálico se recoge en el fondo de la cámara del horno. Tiene una pureza del 99 por ciento y se purifica aún más mediante destilación al vacío.
Datos sobre el zinc
- El metal plateado brillante, zinc, pertenece al bloque 3d, pero no forman un compuesto en el que la capa d esté parcialmente ocupada.
- Debido a la protección deficiente, los electrones d ingresan al núcleo interno. La energía de ionización del zinc también se explica por los hechos anteriores.
- La tercera energía de ionización de Zn es significativamente más alta que la primera o la segunda, lo que indica un enlace más fuerte para los electrones d.
- El estado de oxidación más estable y común del elemento zinc es +2.
- Tiene ciertas similitudes con el grupo principal o los elementos del bloque s debido a la presencia de ns2 configuración electrónica exterior.
- El elemento es similar al metal de transición en que forma varios compuestos complejos con una variedad de ligandos como amoníaco, aminas, haluros y cianuros.
- Pero no se conocen los complejos con otros ligandos aceptores pi fuertes, como carbonilo, nitrosilo y olefinas.
- El metal reacciona fácilmente con oxígeno, azufre, fósforo y halógenos para formar una variedad de compuestos químicos simples.
Ingredientes químicos
La gran diferencia entre las energías de ionización 1ª y 2ª de Zn, Cd y Hg sugiere la formación de M+ el ion es posible.
En la práctica, el estado univalente ocurre y es importante para el mercurio en forma de Hg.2+2. Mientras que el estado +2 es favorable para los átomos de Zn y Cd debido a la mayor energía de hidratación de los iones +2.
Los óxidos, sulfuros y haluros de Zn(II) son los principales compuestos binarios del metal. También forma hidruros, nitruros y carburos (acetiluros) inestables.
¿Qué es el óxido de zinc?
El óxido de zinc es el óxido común de Zn con la fórmula molecular ZnO. El ZnO se forma calentando ZnS en el aire o por descomposición térmica del carbonato de zinc.
Es blanco a temperatura normal. ZnO se vuelve amarillo debido a la pérdida de oxígeno de la red de ZnO para formar un compuesto no estequiométrico como Zn1+xO. Los puntos vacíos de la cuadrícula pueden capturar electrones que son excitados por la radiación electromagnética visible para exhibir un color amarillo.
Es de naturaleza anfótera y se disuelve en ácidos para formar Zn. Dar forma+2 ion.
sulfuro de zinc
El sulfuro de zinc (fórmula química ZnS) es bien conocido por nosotros en el análisis de grupo de rutina. El ZnS se produce por reacción directa de Zn(II) acuoso con sulfuro de hidrógeno.
El ZnS se presenta en dos formas sólidas cristalinas, como la mezcla de zinc o la wurtzita. Se transforman entre sí a 1020°C. Son fácilmente solubles en ácidos diluidos.
haluros
Los cuatro haluros metálicos de zinc (ZnF2ZnCl2ZnBr2y ZnI2) Son conocidos. El cloruro, bromuro y yoduro de zinc también son iónicos con una polarización eléctrica considerable. Cristalizan como redes de capas. Fluoruro como ZnF2 es iónico y altamente soluble en agua.
Sulfato de cinc
El sulfato de zinc, también llamado vitriolo blanco, es un sólido cristalino incoloro que se desvanece con la fórmula química ZnSO4.
Industrial, ZnSO4 se prepara tostando el mineral de sulfuro al aire por debajo de 700°C y lixiviando la masa con ácido sulfúrico diluido.
ZnSO4 es ampliamente utilizado para hacer impresiones de calicó y lociones para los ojos. También se utiliza en medicina para complementar la ingesta de Zn.
otras conexiones
La forma cristalina del nitrato de zinc, Zn (NO3)26 horas2El O se obtiene de la solución de ZnCO3 en ácido nítrico diluido.
El acetato de zinc es otra forma cristalina del elemento con la fórmula molecular Zn (CH3ARRULLO)22H2O. Se obtiene a partir de la disolución de ZnO en ácido acético glacial tibio.
Uso de zinc
Se utiliza principalmente para proporcionar un revestimiento resistente a la corrosión en hierro. Se puede aplicar una capa delgada del metal depositando Zn en el electrodo de Fe (cátodo) mediante electrólisis o sumergiéndolo en zinc fundido.
- El primer proceso se llama electrodeposición (galvanización).
- La inmersión de metal en Zn fundido se denomina galvanizado en caliente.
- El recubrimiento metálico también se aplica ahorrando zinc sobre otros metales o calentando con polvo de Zn.
El segundo uso principal del zinc es hacer varios tipos de aleaciones como el latón. Estas aleaciones se utilizan ampliamente en la fabricación de piezas de maquinaria, como tambores, válvulas, cartuchos y fundición a presión.
El metal, Zn, se usa en la fabricación de celdas secas o baterías para linternas, transistores, industrias automotriz, eléctrica y de hardware.
Un compuesto metálico como el óxido de zinc es el ingrediente principal para fabricar pinturas, caucho, cosméticos, productos farmacéuticos, plásticos, tintas, jabones y baterías.
El óxido de zinc también se usa ampliamente en la industria textil y en la medicina.