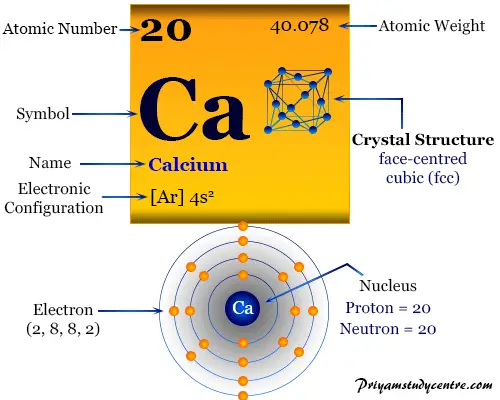
El Calcio, conocido como "calcio elemento" en química, es un metal perteneciente al Grupo-2 (IIA) de la tabla periódica calcio con el símbolo de calcio Ca y número atómico 20. Este vital símbolo del calcio es el elemento esencial en el cuerpo humano para formar huesos, coagular sangre, contraer músculos y hacer latir nuestro corazón.
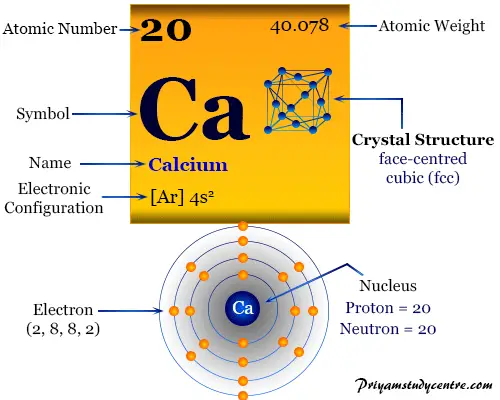

Alrededor del 90 por ciento del calcio en el cuerpo humano se usa para formar huesos y dientes. Es un metal blanco plateado, brillante y relativamente duro en comparación con otros metales alcalinotérreos.
Lectura relacionada:La configuración electrónica del calcio elemento sugiere que el metal tiene dos electrones disponibles para el enlace químico. Por tanto, el número de oxidación general o estado del Ca es +2.
Propiedades del Calcio
El calcio se forma como una red cristalina cúbica centrada en las caras con un punto de fusión más alto que los metales alcalinos.
Presenta una 4s2 configuración electrónica de la capa de valencia sobre el gas noble anterior argón. La s2 configuración conduce a la inclusión en el Grupo-2 o IIA de la tabla periódica.
Lectura relacionada: Sodio, Símbolo, Propiedades, Hechos, Uso, Compuestos
Sodio, Símbolo, Propiedades, Hechos, Uso, CompuestosAlgunas propiedades importantes del metal se dan debajo de la tabla,
| Propiedades del Calcio |
|||
| Número atómico | 20 | ||
| Electrón por escala | 2, 8, 8, 2 | ||
| Peso atomico | 40.078 | ||
| Configuración electrónica | [Ar] 4s2 | ||
| Bloquear | bloque s | ||
| Período de tiempo | 4 | ||
| Grupo | 2 | ||
| Punto de fusion | 842°C, 1548°F | ||
| Punto de ebullición | 1484°C, 2703°F | ||
| Capacidad calorífica molar | 25,929 J mol−1 k1 | ||
| estructura cristalina | cúbico centrado en las caras (fcc) | ||
| Espesor | 1,55 g/cm23 | ||
| Número de oxidación común o estado: | +2 | ||
| Electronegatividad | 1,00 (escala de Pauling) | ||
| Energía de ionización (kJ/mol) | 1º | 2do | 3ro |
| 589.8 | 1145.4 | 4912.4 | |
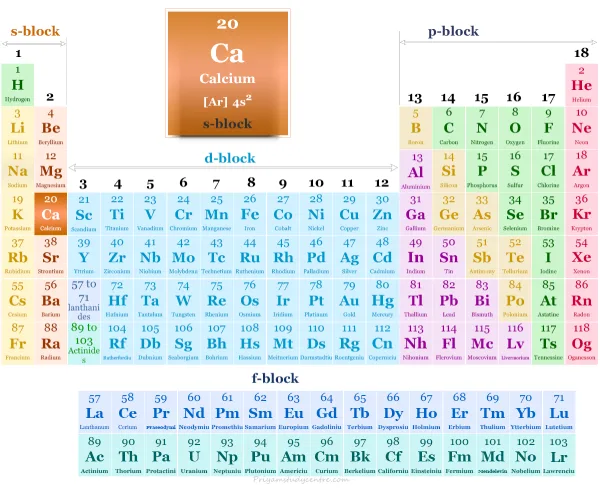
Calcio en la tabla periódica
Debido a dos electrones en el orbital de valencia, el "calcio simbolo" se colocó en el bloque s de la tabla periodica calcio con otros miembros del grupo, como el berilio, magnesio, estroncio, bario y radio.
 Berilio, Símbolo, Propiedades, Hechos, Conexiones, Uso
Berilio, Símbolo, Propiedades, Hechos, Conexiones, Uso
¿Dónde se encuentra el calcio?
El calcio es el quinto elemento más abundante (3,63 por ciento) en la corteza terrestre. Se concentra en minerales que probablemente se secretan durante la fase principal de la cristalización del magma.
La meteorización y la lixiviación conducen a la formación de minerales carbonato de calcio (CaCO3) o piedra caliza en la tierra. La muy baja solubilidad de CaCO3 es la razón más probable de la ausencia de una cantidad significativa de Ca+2 ión en agua de mar.
Yeso (CaSO42H2O), espato flúor (CaF2) y apatito [3Ca3(PO4)2, CaF2] son importantes minerales de calcio.
Fuentes de calcio
Todos los días perdemos calcio de nuestro cuerpo a través de la piel, las uñas, el cabello, el sudor, la orina y las heces, pero nuestro cuerpo no puede producir "calcio simbolo" Ca. Por tanto, debemos ingerir alimentos o verduras que contengan Ca y mantener la deficiencia de Ca a raya en nuestro organismo.
Los productos lácteos (leche, yogur, queso) y las verduras de hoja verde, como los frijoles, el brócoli, las coles de Bruselas, la col rizada y las hojas de mostaza, son las principales fuentes de calcio para nuestras necesidades diarias.
Isótopos de Ca
El calcio natural es una mezcla de cinco isótopos estables como 40Ca, 42Ca, 43Ca, 44Ca y 46Ca. El isótopo radiactivo 48Ca (vida media de alrededor de 4,3 × 1019 años) puede considerarse estable.
Es el primer elemento más ligero que contiene seis isótopos naturales.
Proceso de producción
El calcio elemento se produce a escala comercial por electrólisis de CaCl2 fundido. Algo de espato flúor (CaF2) se agregó debido a las temperaturas más bajas para la fusión.
La electrólisis se lleva a cabo en una olla de grafito que sirve como electrodo o ánodo. Un cátodo de hierro enfriado por agua cuelga en el electrolito fundido.
El metal producido se deposita sobre el cátodo en forma de varilla a medida que avanza la electrólisis. Una capa de electrolito fundido protege el metal de la oxidación.
Datos sobre el calcio
Los elementos del grupo 2 de la tabla periódica se caracterizan por dos electrones de valencia en una capa s de los átomos. Estos dos electrones siempre están involucrados juntos para demostrar la bivalencia uniforme del metal.
Las propiedades de elementos como Ca, St, Ba, Ra y sus compuestos cambian sistemática y gradualmente con el aumento del número atómico.
El carácter electropositivo o metálico y el radio iónico aumentan de calcio a radio. La estabilidad térmica de carbonatos, nitratos y sulfatos también aumenta de Ca a Ra.
Ingredientes químicos
hidruro de calcio
El hidruro de calcio se forma por enlace iónico debido a la alta naturaleza electropositiva y al gran tamaño del metal. CaH2 es un sólido cristalino de alta ganancia, que conduce la electricidad en estado fundido y libera hidrógeno por electrólisis.
El hidruro se obtiene por combinación directa de hidrógeno con el metal. La reacción de CaH2 con agua proporciona una fuente fácil de hidrógeno.
Óxido de calcio
Todos los óxidos de los elementos del Grup-2 son iónicos con un alto punto de fusión, pero el óxido de berilio se forma por enlace covalente.
La tendencia a formar peróxido y superóxido aumenta con el aumento del número atómico de los elementos del Grupo 2. El superóxido de calcio se forma por la reacción del peróxido de metal con peróxido de hidrógeno al 30 por ciento.
Los óxidos reaccionan con el agua para formar hidróxidos. Las propiedades básicas de los hidróxidos del Grupo 2 aumentan de berilio a bario.
haluro de calcio
Todos los haluros de Ca cristalinos son de naturaleza iónica con un alto punto de fusión. Fluoruro de calcio CaF2 es un sólido insoluble en agua con un punto de fusión alto (punto de fusión 1418°C), mientras que el cloruro de calcio tiene un punto de fusión más bajo y es soluble en agua.
El bromuro y el yoduro de calcio tienen una fusión aún más baja y son más solubles en agua y alcohol.
¿Para qué sirve el calcio?
- Debido a una fuerte afinidad química por el oxígeno y el azufre, el calcio metálico se usa ampliamente para fabricar acero.
- Es un importante agente reductor para la producción de cromo, circonio, torio y uranio.
- Se utiliza como depurador en la industria siderúrgica para eliminar oxígeno, azufre y fósforo.
- El calcio se utiliza en la aleación de aluminio para mejorar la resistencia del metal.
- Se utiliza para eliminar el nitrógeno del argón.
- También se utiliza para producir el compuesto químico hidruro de calcio (CaH2).
Función en el cuerpo humano
Alrededor del 90 por ciento del metal en el cuerpo humano se usa para fabricar huesos y dientes.
No solo desempeña un papel estructural importante, sino que también desempeña funciones regul