¿Qué es el potasio?
Potasio es un elemento químico o metal alcalino blanco plateado del Grupo-1 o IA de la tabla periódica con el símbolo k y número atómico 19. Fue aislado por primera vez por Humphrey Davy en 1807 mediante electrólisis de hidróxido de potasio fundido (KOH) con una batería voltaica. Está ampliamente involucrado en varios tipos de procesos biológicos en nuestras vidas.
Muchos compuestos de potasio se han utilizado desde los primeros días de la civilización humana. La gran diferencia entre la primera y la segunda energía de ionización sugiere que el número de oxidación o estado preferido del potasio será +1.
Lectura relacionada: Magnesio, Propiedades, Hechos, Conexiones, Uso
Magnesio, Propiedades, Hechos, Conexiones, UsoPropiedades del potasio
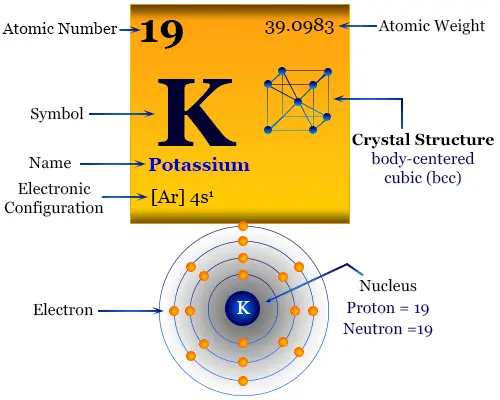
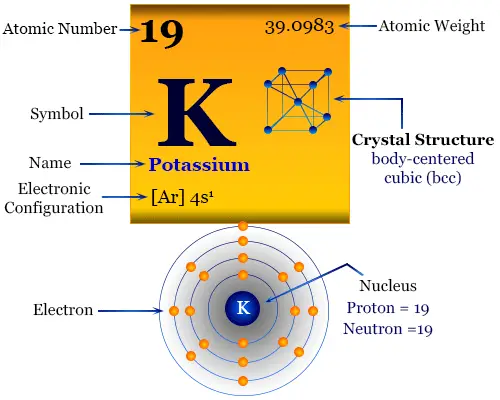
Las propiedades físicas y químicas del potasio se pueden entender fácilmente en términos de su configuración electrónica externa. Tiene solo un electrón en el orbital s sobre un núcleo de gas noble. Debido a la muy baja energía de primera ionización, pierde un electrón para formar una K. Dar forma+ catión.
El potasio tiene el tamaño más grande entre los elementos del período 3. El gran tamaño y la pequeña carga del catión promovieron la formación de enlaces iónicos en los compuestos. La pequeña afinidad electrónica y la electronegatividad también conducen a la formación de compuestos iónicos.
Da una llama violeta característica debido a la fácil excitación del electrón más externo. Este hecho conduce al desarrollo de la química analítica para la estimación de metales por fotómetro de llama. El nombre, el símbolo, el descubrimiento y algunas propiedades importantes de los elementos se dan debajo de la tabla.
Lectura relacionada: Zinc, Símbolo, Propiedades, Hechos, Conexiones, Uso
Zinc, Símbolo, Propiedades, Hechos, Conexiones, Uso| Propiedades del potasio |
|||
| Nombre | potasio | ||
| Símbolo | k | ||
| Nombre derivado de | La palabra inglesa 'potash' | ||
| Descubrimiento | Humphry Davy en 1807 | ||
| número atómico | 19 | ||
| Peso atomico | 39.0983 | ||
| isótopo común | 39k | ||
| electrón por escala | 2, 8, 8, 1 | ||
| Configuración electrónica | [Ar] 4s1 | ||
| Bloquear | bloque s | ||
| Período de tiempo | periodo-4 | ||
| Grupo | grupo 1 | ||
| Punto de fusion | 63,5 °C, 146,3 °F | ||
| Punto de ebullición | 759°C, 1398°F | ||
| Espesor | 0,89 g/cm3 | ||
| Capacidad calorífica molar | 29,6 J mol−1 K−1 | ||
| estructura cristalina | red cristalina cúbica centrada en el cuerpo (bcc) | ||
| Estado de oxidación común: | +1 | ||
| electronegatividad | 0,82 (escala de Pauling) | ||
| Energía de ionización (kJ/mol) | 1º | 2do | 3ro |
| 418.8 | 3052 | 4420 | |
| número CAS | 7440-09-7 | ||
Potasio en la tabla periódica
La configuración electrónica de la capa de valencia del potasio. [Ar] 4s1. Por lo tanto, se coloca en el bloque s de la tabla periódica con miembros del grupo de hidrógeno, litio, sodio, rubidio y francio.
 Cobalto, Símbolo, Historia, Propiedades, Hechos, Uso
Cobalto, Símbolo, Historia, Propiedades, Hechos, Uso¿Dónde se encuentra el potasio?
Todos los metales alcalinos como Li, Na, K, Rb y Cs están ampliamente distribuidos en la corteza terrestre de nuestra naturaleza. Con el aumento del número atómico, los elementos se vuelven raros. Sylvita (KCl), silvinita (KCl, NaCl) y carnalita (KCl, MgCl26 horas2O) son los minerales más comunes de potasio metálico.
Al igual que el sodio, las sales de K también se eliminan por lixiviación de los minerales de silicio debido a las influencias climáticas. Los minerales solubles del metal se llaman potasa. Una gran cantidad de potasio se encuentra en muchos lugares del mundo, como Alemania, el Reino Unido y Canadá.
isótopos
Hay 25 isótopos conocidos de potasio, pero solo tres como 39k, 40K, y 41k se dan en la naturaleza. Los isótopos radiactivos de K se han utilizado como trazadores en estudios de meteorización y medicina.
Proceso de producción
No se prefiere la producción comercial de potasio por electrólisis de KCl fundido porque es fácilmente soluble en el electrolito fundido y no flota en la parte superior. Comercialmente, se preparaba por reducción de KCl fundido con sodio metálico a 850 °C.
El proceso de reducción es bastante inusual porque el K es un mejor agente reductor que el Na, pero a 850°C están en equilibrio químico. Pero una mayor volatilidad de K en el rango de temperatura de 850 °C a 880 °C desplaza el equilibrio hacia la derecha. Por lo tanto, se llevó a cabo una destilación fraccionada para obtener el metal.
Datos interesantes sobre el potasio
La gran diferencia entre la primera y la segunda energía de ionización de los elementos sugiere que el estado de oxidación preferido de los metales alcalinos será +1.
La energía de ionización inicial del potasio es mayor que la energía de red compensada para la mayoría de los compuestos iónicos. Por lo tanto, la química principal del potasio está dominada en forma de K+ iones
Ingredientes químicos
hidruro de potasio
Todos los hidruros de metales alcalinos son de naturaleza iónica y contienen H ion. El hidruro de potasio se forma por la combinación directa de hidrógeno con metal a una temperatura de 350 a 600 °C. La red cristalina cúbica, KH, es un sólido incoloro con un punto de fusión moderadamente alto. En la electrólisis de hidruro, el metal migra al electrodo positivo o cátodo y el hidrógeno migra al electrodo negativo o ánodo.
Óxido de potasio
El potasio reacciona fácilmente con el oxígeno para formar una serie de compuestos binarios, como el monóxido (K2O), peróxido (K2O2) y superóxido (KO2). La estabilidad de los superóxidos aumenta al aumentar el tamaño atómico de los cationes. El peróxido se prepara por oxidación del metal en amoníaco líquido por oxígeno. Se utiliza para restaurar el oxígeno en submarinos y cápsulas espaciales para respiradores de conductores.
Hidróxido de potasio
El hidróxido de potasio (KOH) es una base muy fuerte con una escala de pH alta. Es un sólido cristalino blanco que es soluble en agua y alcohol. El punto de fusión de los hidróxidos alcalinos disminuye con el aumento del número atómico de los metales alcalinos. La medición de las afinidades de protones de los hidróxidos alcalinos sugiere que la fuerza de la base aumenta de LiOH a CsOH.
haluro de potasio
Los haluros de potasio son sólidos cristalinos incoloros con un alto punto de fusión, punto de ebullición y alta conductividad en estado fundido. Todos se pueden preparar con KOH o K. responder2CO3 con haluro de hidrógeno adecuado. Para un catión dado, la energía de red disminuye de litio a cesio y para un metal alcalino en particular, la energía de red disminuye de flúor a yodo. Todos los haluros de metales alcalinos cristalizan como una red cristalina cúbica centrada en las caras.
¿Para qué sirve el potasio?
Para la mayor parte del suelo, K+ El ion es una parte esencial de la nutrición de las plantas. El cloruro de potasio (KCl) es un compuesto importante que se usa en varios tipos de fertilizantes para aumentar la producción de cultivos. Los fertilizantes agrícolas consumen el 90 por ciento de la producción mundial de metales en forma de KCl. Forma una aleación de Na-K que se utiliza en el intercambiador de calor de los reactores reproductores.
Muchos compuestos como KCl, KOH, K2CO3Otorrinolaringología3KClO3KBr y KMnO4 se utilizan en varios tipos de industrias químicas.
| Compuestos de potasio | Aplicaciones |
| KCl | utilizado en importantes fertilizantes como el carbonato de potasio (MOP). |
| KOH | utilizado en el procesamiento de caucho y preparación de fosfato de potasio. |
| k2CO3 | Se utiliza en industrias de vidrio decorativo, tubos de televisión en color, textiles, tintes y pigmentos. |
| KClO3 | utilizado en explosivos y fósforos. |
| KBr | utilizado en fotografía. |
| KMnO4 | agente oxidante o lejía. |
Es combustión directa en aire u oxígeno a KO. Dar forma2que se utiliza en suplementos de oxígeno para submarinos y cápsulas espaciales.
función biológica
La función del sodio y el potasio para penetrar la membrana celular difiere debido a su tamaño iónico. Los metales también difieren en su mecanismo de transporte y eficiencia para activar enzimas. El potasio se produce en una alta concentración en la célula, pero el sodio se produce en una menor concentración en la célula.
El potasio se utiliza principalmente para activar muchas enzimas, la transmisión de señales nerviosas y participar en la oxidación de la glucosa para producir trifosfato de adenosina (ATP).