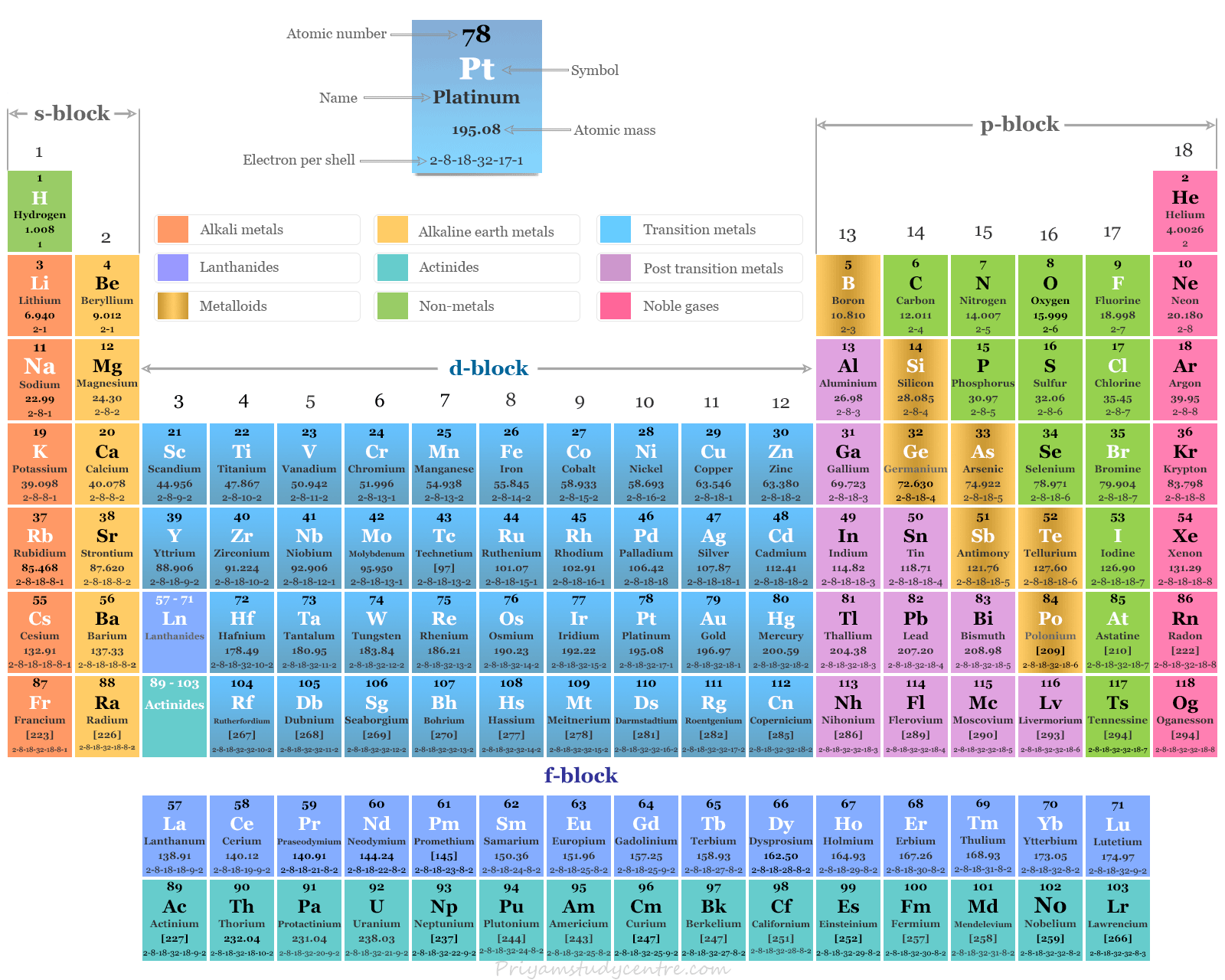
- ¿Qué son los metales de transición?
- Configuración electrónica de elementos de transición
-
Propiedades de los elementos de transición
- Carácter metálico de los elementos de transición.
- Tendencias del punto de fusión de los metales de transición
- Radios atómicos e iónicos de los elementos de transición.
- Energía de ionización de los metales de transición.
- Número de oxidación de los metales de transición.
- Actividad catalítica de los metales de transición.
¿Qué son los metales de transición?
metales de transición o elementos de transición en la tabla periódica están los elementos químicos del bloque d que se encuentran entre los elementos del bloque p y s. Estos elementos, ya sea en su estado atómico o en cualquiera de sus números o estados de oxidación comunes, tienen un orbital (n-1)d parcialmente lleno.
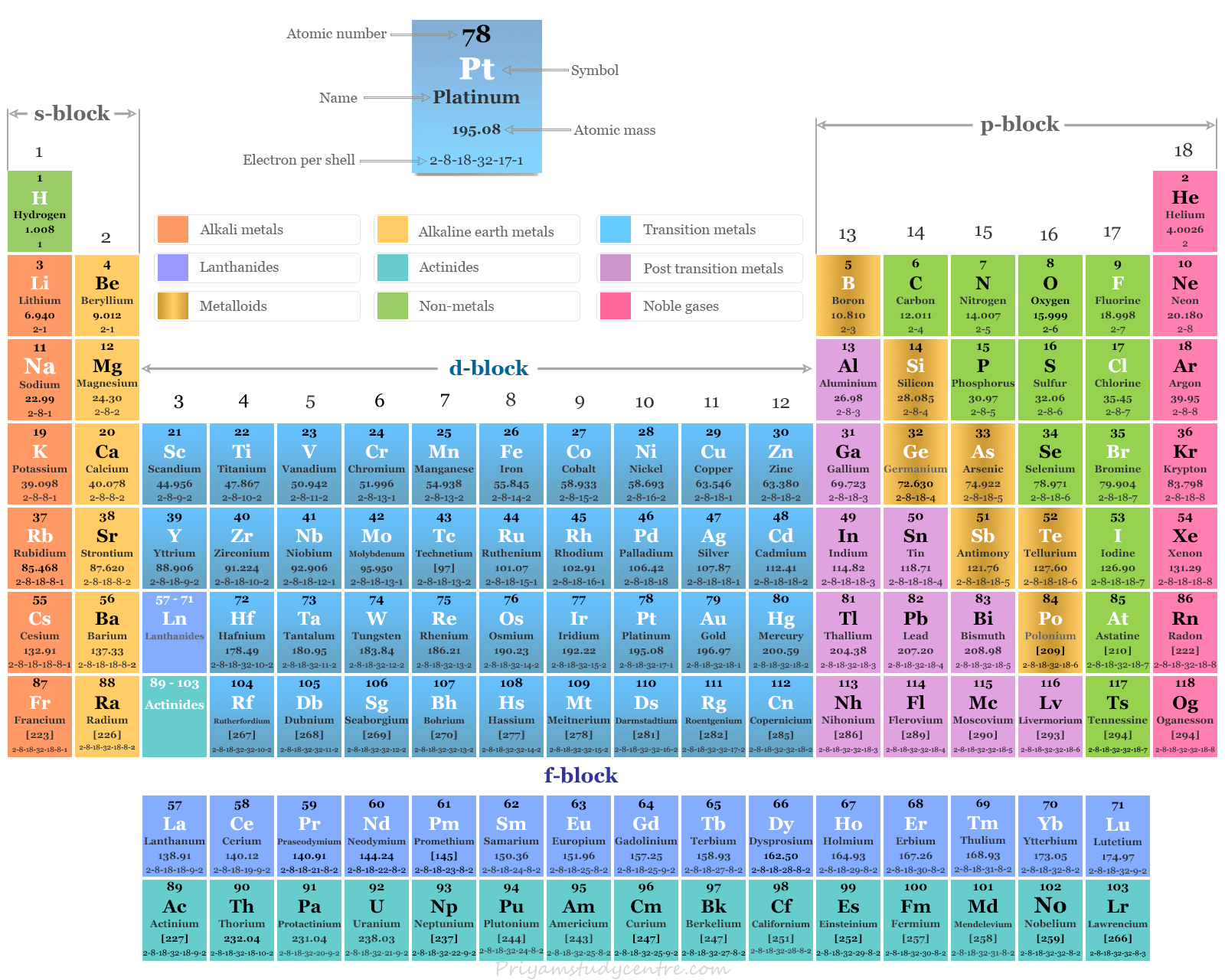
La configuración electrónica de la capa de valencia de los elementos del bloque d o metales de transición,
(n−1)d1 a 10 NS0, 1, 2
 Elementos de tierras raras: metales, definición, propiedades, usos
Elementos de tierras raras: metales, definición, propiedades, usosLos elementos del bloque f (lantánidos o elementos de tierras raras y actínidos) en la tabla periódica se denominan metales de transición internos. Se denominan metales de transición internos porque el electrón extra entra en los orbitales (n−2)f.
Metales de transición en la tabla periódica
De acuerdo con la definición de metal de transición, el cobre, la plata y el oro deben excluirse de los elementos del bloque d en la tabla periódica. Porque estos elementos no tienen orbitales d parcialmente llenos en su estado de oxidación atómico o común.
De manera similar, el zinc, el cadmio, el mercurio y el paladio no contienen un orbital d parcialmente lleno en su estado de oxidación atómico u ordinario +2.
Lectura relacionada: Calcio, Símbolo, Propiedades, Hechos, Uso, Función
Calcio, Símbolo, Propiedades, Hechos, Uso, FunciónDebido a propiedades similares y para mantener una clasificación racional, estos elementos generalmente se estudian con bloques d o metales de transición.
Configuración electrónica de elementos de transición
Todos los elementos de transición o elementos de bloque d se clasifican en cuatro series, como 3d, 4d, 5d y 6d. Cada secuencia 3d, 4d, 5d y 6d tiene diez elementos químicos.
La configuración electrónica general de la capa de valencia de los elementos de transición,
(n-1)d1 a 10 NS0, 1, 2
| elemento de transición | Símbolo | número atómico | Configuración electrónica |
| Itrio | Y | 39 | [Kr] 4d1 5s2 |
| zerconio | Zr | 40 | [Kr] 4d2 5s2 |
| Niobio | Nótese bien | 41 | [Kr] 4d4 5s1 |
| molibdeno | mes | 42 | [Kr] 4d5 5s1 |
| tecnecio | tc | 43 | [Kr] 4d5 5s2 |
| rutenio | tu | 44 | [Kr] 3d7 5s1 |
| Rodio | Rh | 45 | [Kr] 3d7 4s2 |
| Paladio | p.d. | 46 | [Kr] 4d10 5s0 |
| Plata | agricultura | 47 | [Kr] 4d10 5s1 |
| Cadmio | CD | 48 | [Kr] 4d10 5s2 |
| elemento de transición | Símbolo | número atómico | Configuración electrónica |
| Lantano | La | 57 | [Xe] 4f0 5d1 6s2 |
| Hafnio | h.f. | 72 | [Xe] 4f14 5d2 6s2 |
| tantalio | ejército de reserva | 73 | [Xe] 4f14 5d3 6s2 |
| Tungsteno | W | 74 | [Xe] 4f14 5d4 6s2 |
| renio | Con respecto a | 75 | [Xe] 4f14 5d5 6s2 |
| Osmio | Os | 76 | [Xe] 4f14 5d6 6s2 |
| iridio | ir | 77 | [Xe] 4f14 5d7 6s2 |
| Platino | punto | 78 | [Xe] 4f14 5d9 6s1 |
| Oro | es | 79 | [Xe] 4f14 5d10 6s1 |
| Mercurio | Hg | 80 | [Xe] 4f14 5d10 6s2 |
| elemento de transición | Símbolo | número atómico | Configuración electrónica |
| Actinio | C.A | 89 | [Rn] 5f0 6d1 7s2 |
| Rutherfordio | radiofrecuencia | 104 | [Rn] 5f14 6d2 7s2 |
| dubnio | base de datos | 105 | [Rn] 5f14 6d3 7s2 |
| seaborgio | sg | 106 | [Rn] 5f14 6d4 7s2 |
| Bohrio | sostén | 107 | [Rn] 5f14 6d5 7s2 |
| Hassio | hora | 108 | [Rn] 5f14 6d6 7s2 |
| meitnerio | Monte | 109 | [Rn] 5f14 6d7 7s2 |
| Darmstadtio | ds | 110 | [Rn] 5f14 6d8 7s2 |
| radiografía | rg | 111 | [Rn] 5f14 6d9 7s2 |
| copernicio | cn | 112 | [Rn] 5f14 6d10 7s2 |
Propiedades de los elementos de transición
Las propiedades de los elementos de transición de un período particular no son tan diferentes entre sí. La razón de esto radica en la configuración electrónica de los elementos de transición.
La configuración electrónica general de los metales de transición difiere entre sí solo en el número de electrones en el orbital d. El número de electrones en la capa externa es invariablemente 0, 1 o 2.
Carácter metálico de los elementos de transición.
Todos los elementos de transición son metales debido a su pequeña cantidad de electrones en la capa cuántica exterior. Son duras, maleables y maleables. Han formado los cuatro tipos de sólidos cristalinos, como redes cristalinas cúbicas, hexagonales cerradas, cúbicas centradas en el cuerpo y cúbicas centrales.
Los enlaces metálicos y covalentes ocurren en átomos de metales de transición. Debido a la presencia del orbital d incompleto, la mayoría de los metales de transición se combinan con otros elementos a través de enlaces químicos covalentes. Estos metales son buenos conductores del calor y la electricidad.
Tendencias del punto de fusión de los metales de transición
Los elementos de transición tienen puntos de fusión y ebullición muy altos en comparación con los elementos de bloque s y p.
Los metales zinc, cadmio y mercurio tienen valores relativamente bajos debido a los orbitales d completamente llenos. No hay electrones desapareados disponibles para el enlace covalente entre los átomos de zinc, cadmio y mercurio.
El otro metal de transición contiene un orbital d incompleto para el enlace covalente.
Radios atómicos e iónicos de los elementos de transición.
Los radios atómicos e iónicos generalmente disminuyen a medida que se mueven de izquierda a derecha en el período. Esto se debe al hecho de que un aumento en la carga nuclear tiende a atraer las nubes de electrones hacia el núcleo de un átomo.
Los rayos atómicos de cromo a cobre están muy cerca uno del otro. Debido a la adición simultánea de electrones de protección al efecto inverso de nivel 3D en los electrones 4s más externos. Los rayos iónicos de M+2 y M+3 Los iones siguen las mismas tendencias que los rayos atómicos.
Energía de ionización de los metales de transición.
La primera energía de ionización de los metales de transición se encuentra entre los valores de s y p elementos de bloque. Los primeros valores de energía de ionización están entre 5 y 10 electronvoltios.
En el caso de los metales de transición, la adición de electrones protectores adicionales protege o reduce la atracción hacia el interior del núcleo positivo y los electrones ns. Los efectos de la carga nuclear creciente y los efectos de blindaje se oponen entre sí.
Debido a estos efectos contrarios, los potenciales de ionización aumentan lentamente a medida que avanzan en un período de la primera serie de transición.
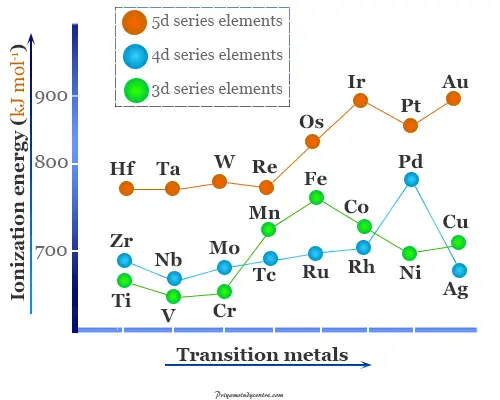
- Se indica claramente en la imagen de arriba que la primera energía de ionización de Ti, V y Cr son ligeramente diferentes entre sí. Asimismo, los valores de Fe, Co, Ni y Cu son bastante próximos entre sí.
- Se ve que la segunda energía de ionización aumenta más o menos regularmente con el aumento del número atómico del bloque d o elementos de transición. Los valores de cromo y cobre de segunda energía de ionización son más altos que los de sus metales de transición adyacentes debido a la estabilidad adicional de Cu+ y Cr+ ion.
Número de oxidación de los metales de transición.
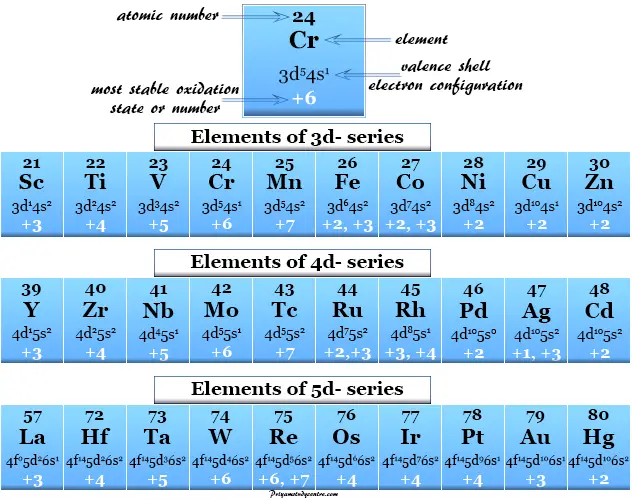
Una de las principales propiedades que distinguen a los metales de transición de los elementos que no son de transición son los números o estados de oxidación variables.
Esta propiedad única se debe al hecho de que los niveles de energía de los orbitales 3D, 4D y 5D están cerca de los orbitales 4s, 5s y 6s, respectivamente. Por lo tanto, además de los electrones ns, los diferentes números de electrones (n−1)d se pierden para mostrar diferentes estados de oxidación.
Actividad catalítica de los metales de transición.
La mayoría de los metales de transición y sus compuestos se utilizan como buenos catalizadores químicos en varios tipos de reacciones. Algunos ejemplos son
- Pentóxido de vanadio (V2O5) se utiliza en la fabricación de ácido sulfúrico en el proceso de contacto.
- El níquel en polvo finamente dividido o níquel activo se utiliza en reacciones de hidrogenación de compuestos orgánicos.
- El platino esponjoso se utiliza en la conversión de dióxido de azufre en trióxido de azufre o en la producción de ácido nítrico mediante el proceso de Ostwald.
- Metal de transición, el hierro se utiliza en la fabricación de amoníaco mediante el proceso Haber.