- Diferencia clave: fórmula Unidad de masa frente a masa molecular
- ¿Qué es la fórmula de masa unitaria?
- ¿Qué es la masa molecular?
- ¿Cuáles son las similitudes entre la masa unitaria de fórmula y la masa molecular?
- ¿Cuál es la diferencia entre la masa unitaria fórmula y la masa molecular?
- Resumen – Fórmula Unidad de masa frente a masa molecular
Diferencia clave: fórmula Unidad de masa frente a masa molecular
La masa unitaria fórmula o masa fórmula de un compuesto es la masa de la fórmula molecular de ese compuesto. La fórmula empírica de un compuesto es la fórmula química que da la relación entre los diferentes átomos presentes en ese compuesto en números enteros pequeños. En otras palabras, es la proporción más pequeña entre elementos químicos en un compuesto. No da el número real de cada elemento químico. Cuando se mide la masa de esta fórmula, se conoce como masa unitaria de fórmula. La masa molecular de un compuesto es la masa de una molécula de una sustancia determinada. La mayoría de las veces, los términos masa molar y masa molecular se usan indistintamente, aunque son términos diferentes. La masa molar es la masa de un mol de la sustancia, mientras que la masa molecular no es la masa de un mol de una sustancia. En moléculas simples, la fórmula masa y masa molecular son las mismas. Sin embargo, en compuestos complejos hay una gran diferencia entre dos valores. Que diferencia principal entre la fórmula de masa unitaria y la masa molecular es que El valor de la masa unitaria fórmula siempre es menor o cercano a la masa molecular de la misma sustancia, mientras que el valor de la masa molecular siempre es mayor o cercano a la masa unitaria fórmula de la misma sustancia.
Lectura relacionada: Diferencia entre ácidos binarios y ternarios.
Diferencia entre ácidos binarios y ternarios.CONTENIDO
1. Descripción general y diferencia clave
2. ¿Qué es la fórmula de masa unitaria?
3. ¿Cuál es la masa molecular?
4. Similitudes entre la masa unitaria de fórmula y la masa molecular
5. Comparación lado a lado: masa unitaria de fórmula frente a peso molecular en forma tabular
6. Resumen
¿Qué es la fórmula de masa unitaria?
La masa unitaria de fórmula o la masa de fórmula es la masa de la fórmula molecular de una sustancia específica. Es decir, es la suma de las masas atómicas de los elementos químicos contenidos en la fórmula molecular. La fórmula empírica es la fórmula química de una sustancia que da la relación más simple entre los elementos químicos presentes en una sustancia. Por ejemplo, la fórmula molecular de C6H12O6 (glucosa) es CH2O. Veamos algunos ejemplos para entender el concepto.
Cálculo de la masa de la unidad fórmula
Fórmula unidad de masa de compuestos simples
En el caso de compuestos simples como NaCl (cloruro de sodio), la fórmula molecular y la fórmula molecular son las mismas. El valor de la fórmula unidad de masa es,
Lectura relacionada: Diferencia entre elementos representativos y transitorios
Diferencia entre elementos representativos y transitorios(masa atómica de Na) + (masa atómica de Cl) = (23 + 35,5) uma = 58,5 uma
Fórmula unidad de masa de compuestos complejos
Para compuestos complejos como C11H22O11 (sacarosa), la fórmula molecular es CH2 Entonces la fórmula es unidad de masa,
(masa atómica de C) + 2 (masa atómica de H) + (masa atómica de O) = (12 + {2×1} + 16) uma = 30 uma.
Lectura relacionada: Diferencia entre clorito de sodio e hipoclorito de sodio.
Diferencia entre clorito de sodio e hipoclorito de sodio.Para los compuestos poliméricos, la masa de la unidad de fórmula es la masa de una unidad repetitiva. Un polímero es una macromolécula formada por muchos compuestos pequeños conocidos como monómeros. Una unidad repetitiva representa el monómero o los monómeros usados para hacer el compuesto polimérico. Por lo tanto, es equivalente a la fórmula molecular de un compuesto complejo.
¿Qué es la masa molecular?
La masa molecular es la masa de una molécula de una sustancia determinada. También se le conoce como peso molecular. El peso molecular se calcula como la suma de las masas atómicas de todos los elementos químicos presentes en la molécula, teniendo en cuenta las proporciones reales entre estos elementos.
Por lo tanto, para compuestos grandes y complejos, el valor de la fórmula de la unidad de masa siempre es mayor que el de la masa molecular. Pero para moléculas pequeñas y simples, ambas pueden ser iguales.
Cálculo de la masa molecular
Consideremos algunos ejemplos para entender el método de cálculo.
Ejemplo: glucosa
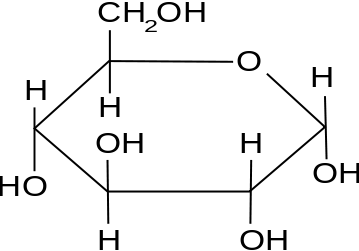
La fórmula química de la glucosa es C6H12O6. Por lo tanto, el peso molecular de la glucosa
6 (masa atómica de C) + 12 (masa atómica de H) + 6 (masa atómica de O)
= 6 (12 uma) + 12 (1 uma) + 6 (16 uma)
= (72 + 12 + 96) uma
= 180 uma.

Figura 01: molécula de glucosa
Ejemplo: carbonato de calcio
La fórmula química del carbonato de calcio es CaCO3 , que es también la fórmula empírica de este compuesto. Por lo tanto, el peso molecular del carbonato de calcio
(masa atómica de Ca) + (masa atómica de C) + 3 (masa atómica de O)
= (40 + 12 + {3 x 16}) uma
= 100 uma
¿Cuáles son las similitudes entre la masa unitaria de fórmula y la masa molecular?
- Tanto la masa unitaria de fórmula como la masa molecular son medidas de peso de sustancias.
- Tanto la masa unitaria de fórmula como la masa molecular tienen la misma unidad de medida.
¿Cuál es la diferencia entre la masa unitaria fórmula y la masa molecular?
Fórmula unidad de masa frente a masa molecular |
|
| La masa unitaria de fórmula o la masa de fórmula es la masa de la fórmula molecular de una sustancia específica. | La masa molecular es la masa de una molécula en una sustancia dada. |
| valor | |
| El valor de la fórmula unidad de masa siempre es menor o similar a la masa molecular de la misma sustancia. | El valor de la masa molecular siempre es mayor o similar a la fórmula unidad de masa de la misma sustancia. |
Resumen – Fórmula Unidad de masa frente a masa molecular
La masa unitaria de fórmula es la masa de la fórmula molecular de una sustancia específica. La masa molecular de una sustancia es la masa real de una molécula de una sustancia determinada. La diferencia entre la masa unitaria fórmula y la masa molecular es que el valor de la masa unitaria fórmula siempre es menor o similar a la masa molecular de la misma sustancia, mientras que el valor de la masa molecular siempre es mayor o similar a la masa unitaria fórmula de la misma sustancia. misma sustancia.
Relación:
1. Helmenstine, Anne Marie, D. "Fórmula de masa versus masa molecular". ThoughtCo, 25 de marzo de 2017. Disponible aquí
2. "Masa molecular". Wikipedia, Fundación Wikimedia, 25 de febrero de 2018. Disponible aquí
3. "Fórmula empírica". Wikipedia, Fundación Wikimedia, 18 de febrero de 2018. Disponible aquí
Imagen de cortesía:
1. "Alpha-D-Glucose Haworth" por Masur (Dominio público) a través de Commons Wikimedia