Que diferencia principal se encuentra entre los números cuánticos azimutal y principal El número cuántico azimutal describe el momento angular de un electrón en un átomo, mientras que el número cuántico principal describe el tamaño de un orbital electrónico.
Lectura relacionada: Diferencia entre el reordenamiento de Cope y Claisen
Diferencia entre el reordenamiento de Cope y ClaisenLos números cuánticos son cantidades importantes para describir los niveles de energía de un átomo. Hay cuatro números cuánticos que podemos usar para describir la posición de un electrón en un átomo. Son el número cuántico principal, el número cuántico azimutal, el número cuántico magnético y el número cuántico de espín.
CONTENIDO
1. Descripción general y diferencia clave
2. ¿Qué es el número cuántico azimutal?
3. ¿Cuál es el número cuántico principal?
4. Comparación lado a lado - número cuántico azimutal vs. principal en forma tabular
5. Resumen
¿Qué es el número cuántico acimutal?
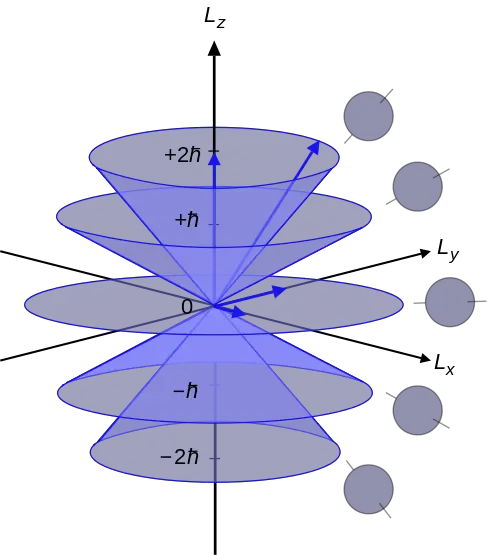
El número cuántico azimutal es el número cuántico que describe el momento angular de un electrón en un átomo. Por lo tanto, también podemos llamarlo el número cuántico del momento angular orbital. La carta "yo” denota el número cuántico azimutal. Además, este número cuántico determina las formas de un orbital en el que existe un electrón. Es el segundo de los cuatro números cuánticos. Por lo tanto, también podemos referirnos a él como el segundo número cuántico (porque los cuatro números cuánticos describen el estado cuántico de un electrón en un átomo). La ecuación que puede relacionar el número cuántico azimutal con el momento angular es la siguiente:
Lectura relacionada: Diferencia entre interacciones iónicas y electrostáticas.
Diferencia entre interacciones iónicas y electrostáticas.L2Ψ=H2yo(yo+1) Ψ
donde L2 es el operador del momento angular orbital, Ψ es la función de onda del electrón y H es la constante de tablón reducida. Aquí, yo es siempre un entero positivo. Según la mecánica cuántica, cada nivel de energía tiene diferentes subcapas. Estas subcapas difieren entre sí en su forma y orientación. Las subcapas de un nivel de energía se nombran como:yo0 y +yo.
| número acimutal | designacion | número de orbitales | Número máximo de electrones |
| 0 | s | 1 | 2 |
| 1 | pags | 3 (=-1, 0, +1) | 6 |
| 2 | es decir | 5 (=-2, -1, 0, +1, +2) | 10 |
| 3 | F | 7 (=-3, -2, -1, 0, +1, +2, +3) | 14 |
 Lectura relacionada:
Lectura relacionada: Diferencia entre regioselectividad y estereoselectividad
Diferencia entre regioselectividad y estereoselectividadFigura 02: Números cuánticos azimutales en el rango de –l, 0 a +l
¿Cuál es el número cuántico principal?
Un número cuántico principal es un número cuántico que describe el nivel de energía principal en el que existe un electrón. Lo podemos denotar con "n". Como es el primero de cuatro números cuánticos diferentes; también podemos llamarlo el primer número cuántico. El valor del número cuántico principal es un número entero positivo a partir de 1, es decir, n=1, 2, 3,...
Cuanto mayor sea el valor del número cuántico principal, mayor será la energía de un electrón; por tanto, el electrón está débilmente unido al átomo. Eso significa; los valores altos de "n" se refieren a niveles de energía más altos. Además, para cada valor "n", hay valores separados para el número cuántico de azimut, el número cuántico magnético y el número cuántico de espín. Esto se debe a que cada nivel de energía tiene sus propias subcapas, orbitales o pares de electrones.
¿Cuál es la diferencia entre número cuántico azimutal y principal?
Los números cuánticos son cantidades importantes para describir los niveles de energía de un átomo. Hay cuatro números cuánticos diferentes, y los dos primeros son el número cuántico principal y el número cuántico azimutal. La diferencia clave entre el número cuántico azimutal y principal es que el número cuántico azimutal describe el momento angular de un electrón en un átomo, mientras que el número cuántico principal describe el tamaño de un orbital electrónico. Podemos denotar el número cuántico azimutal como “yo' y el número cuántico principal como 'n'.
Además, el número cuántico azimutal describe el momento angular y la forma de un orbital, mientras que el número cuántico principal describe el nivel de energía en el que reside un electrón.
La siguiente infografía resume la diferencia entre el acimut y el número cuántico principal.

Resumen - Azimutal vs Número cuántico principal
Los números cuánticos son valores que describen los niveles de energía de un átomo. Hay cuatro números cuánticos diferentes, y los dos primeros son el número cuántico principal y el número cuántico azimutal. La diferencia clave entre el número cuántico azimutal y principal es que el número cuántico azimutal describe el momento angular de un electrón en un átomo, mientras que el número cuántico principal describe el tamaño de un orbital electrónico.
Relación:
1. Helmenstine, Annemarie. "Definición de número cuántico acimutal". ThoughtCo, 22 de junio de 2018, disponible aquí.
2. Helmenstine, Anne Marie. "Definición principal de número cuántico". ThoughtCo, 6 de noviembre de 2019, disponible aquí.
Imagen de cortesía:
1. "Modelo vectorial de momento angular orbital" por Maschen - Trabajo propio (Dominio público) a través de Commons Wikimedia