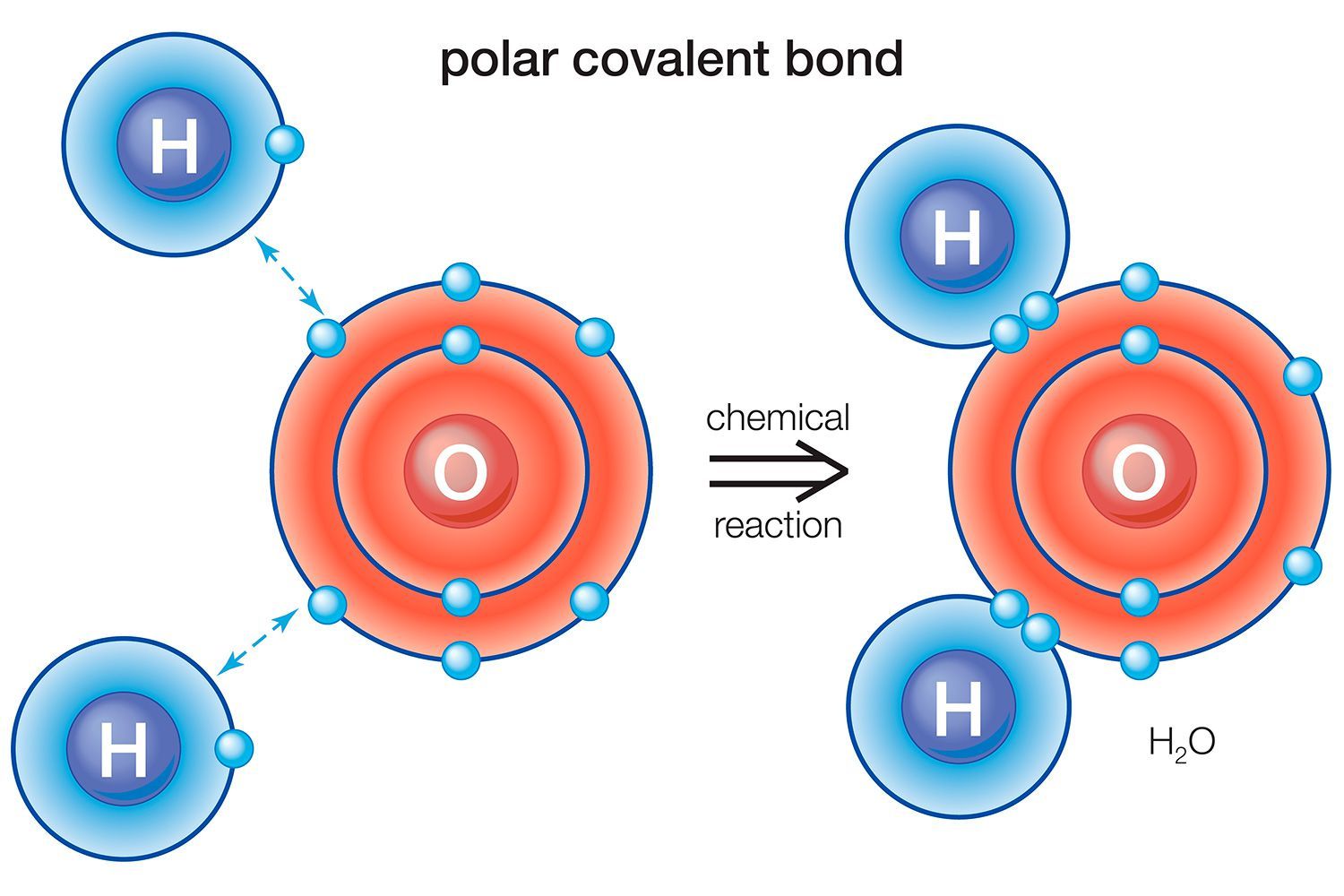
Los enlaces químicos pueden clasificarse como polares o no polares. La diferencia es cómo están dispuestos los electrones en el enlace.
Conclusiones Clave: ¿Qué es un Enlace Polar en Química?
- Un enlace polar es un tipo de enlace covalente en el que los electrones que forman el enlace están distribuidos de manera desigual. En otras palabras, los electrones pasan más tiempo en un lado del enlace que en el otro.
- Los enlaces polares son intermedios entre los enlaces covalentes puros y los enlaces iónicos. Se forman cuando la diferencia de electronegatividad entre el anión y el catión está entre 0,4 y 1,7.
- Los ejemplos de moléculas con enlaces polares incluyen agua, fluoruro de hidrógeno, dióxido de azufre y amoníaco.
Definición de Enlace Polar
Un enlace polar es un enlace covalente entre dos átomos donde los electrones que forman el enlace están distribuidos de manera desigual. Esto hace que la molécula tenga un ligero memento dipolar eléctrico en el que un extremo es ligeramente positivo y el otro es ligeramente negativo. La carga de los dipolos eléctricos es menor que una carga unitaria completa, por lo que se consideran cargas parciales y se denotan por delta más (δ+) y delta menos (δ -). Debido a que las cargas positivas y negativas están separadas en el enlace, las moléculas con enlaces covalentes polares interactúan con dipolos en otras moléculas. Esto produce fuerzas intermoleculares dipolo-dipolo entre las moléculas.
Lectura relacionada: ¿Cómo Funciona el Pez Milagroso Adivino?
¿Cómo Funciona el Pez Milagroso Adivino?
Los enlaces polares son la línea divisoria entre el enlace covalente puro y el enlace iónico puro. Los enlaces covalentes puros (enlaces covalentes no polares) comparten pares de electrones por igual entre los átomos. Técnicamente, los enlaces no polares solo ocurren cuando los átomos son idénticos entre sí (por ejemplo, H2 gas), pero los químicos consideran que cualquier enlace entre átomos con una diferencia de electronegatividad inferior a 0,4 es un enlace covalente no polar. Dióxido de carbono (CO2) y metano (CH4) son moléculas no polares.
Pero, ¿Los Enlaces Iónicos No Son Polares?
En los enlaces iónicos, los electrones en el enlace son esencialmente donados a un átomo por el otro (por ejemplo, NaCl). Los enlaces iónicos se forman entre átomos cuando la diferencia de electronegatividad entre ellos es mayor que 1,7. Técnicamente, los enlaces iónicos son enlaces completamente polares, por lo que la terminología puede ser confusa.
Lectura relacionada: ¿Cuáles Son los Primeros 20 Elementos?
¿Cuáles Son los Primeros 20 Elementos?
Solo recuerde que un enlace polar se refiere a un tipo de enlace covalente donde los electrones no se comparten por igual y los valores de electronegatividad son ligeramente diferentes. Se forman enlaces covalentes polares entre átomos con una diferencia de electronegatividad entre 0,4 y 1,7.
Ejemplos de Moléculas con Enlaces Covalentes Polares
Agua (H2O) es una molécula unida polar. El valor de electronegatividad del oxígeno es 3,44, mientras que la electronegatividad del hidrógeno es 2,20. La desigualdad en la distribución de electrones explica la forma doblada de la molécula. El "lado" de oxígeno de la molécula tiene una carga negativa neta, mientras que los dos átomos de hidrógeno (en el otro "lado") tienen una carga positiva neta.
Lectura relacionada: Nombrar Cadenas Alquínicas Simples
Nombrar Cadenas Alquínicas Simples
El fluoruro de hidrógeno (HF) es otro ejemplo de una molécula que tiene un enlace covalente polar. El flúor es el átomo más electronegativo, por lo que los electrones en el enlace están más estrechamente asociados con el átomo de flúor que con el átomo de hidrógeno. Se forma un dipolo con el lado de flúor que tiene una carga negativa neta y el lado de hidrógeno que tiene una carga positiva neta. El fluoruro de hidrógeno es una molécula lineal porque solo hay dos átomos, por lo que no es posible otra geometría.
La molécula de amoníaco (NH3) tiene enlaces covalentes polares entre los átomos de nitrógeno e hidrógeno. El dipolo es tal que el átomo de nitrógeno está más cargado negativamente, con los tres átomos de hidrógeno todos en un lado del átomo de nitrógeno con una carga positiva.
¿Qué Elementos Forman Enlaces Polares?
Se forman enlaces covalentes polares entre dos átomos no metálicos que tienen electronegatividades suficientemente diferentes entre sí. Debido a que los valores de electronegatividad son ligeramente diferentes, el par de electrones de enlace no se comparte por igual entre los átomos. Por ejemplo, los enlaces covalentes polares se forman típicamente entre hidrógeno y cualquier otro no metal.
El valor de electronegatividad entre metales y no metales es grande, por lo que forman enlaces iónicos entre sí. Por lo general, el hidrógeno actúa como un no metal en lugar de como un metal.
Fuentes
- Ingold, C. K.; Ingold, E. H. (1926). "La Naturaleza del Efecto Alterno en las Cadenas de Carbono. Parte V. Una Discusión de la Sustitución Aromática con Especial Referencia a los Roles Respectivos de la Disociación Polar y No Polar; y un Estudio Adicional de las Eficiencias Directivas Relativas del Oxígeno y el Nitrógeno". J. Chem. Soc.: 1310–1328. doi: 10.1039 / jr9262901310
- Pauling, L. (1960). La Naturaleza del Enlace Químico (3ª ed.). Oxford University Press. pp.98-100. ISBN 0801403332.
- Ziaei-Moayyed, Maryam; Goodman, Edward; Williams, Peter (1 de noviembre de 2000). "Deflexión Eléctrica de Corrientes Líquidas Polares: Una Demostración Incomprendida". Revista de Educación Química. 77 (11): 1520. doi: 10.1021 / ed077p1520