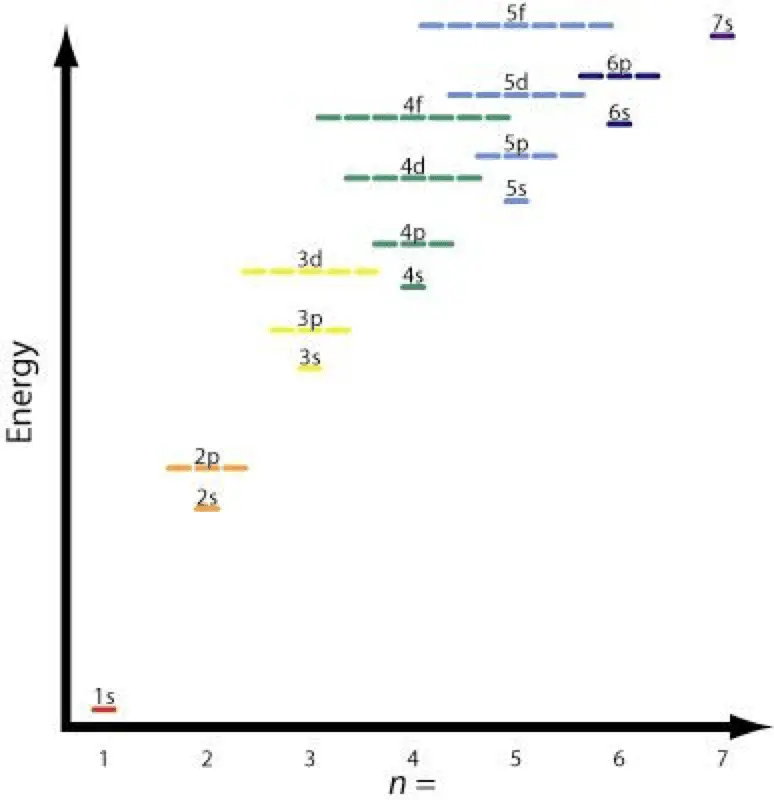
Los átomos estables tienen tantos electrones como protones en el núcleo. Los electrones se reúnen alrededor del núcleo en orbitales cuánticos siguiendo cuatro reglas básicas llamadas principio de Aufbau.
- No hay dos electrones en el átomo que compartan los mismos cuatro números cuánticos n, l, m, y s.
- Los electrones ocuparán primero los orbitales del nivel de energía más bajo.
- Los electrones llenarán un orbital con el mismo número de espín hasta que el orbital se llene antes de que comience a llenarse con el número de espín opuesto.
- Los electrones llenarán los orbitales por la suma de los números cuánticos n y l. Orbitales con valores iguales de (n+l) se llenará con la parte inferior n los valores primero.
La segunda y cuarta reglas son básicamente las mismas. El gráfico muestra los niveles de energía relativos de los diferentes orbitales. Un ejemplo de la regla cuatro sería la 2p y 3s orbitales. A 2p orbital es n = 2 y l = 2 y un 3s orbital es n = 3 y l = 1; (n + l) = 4 en ambos casos, pero el 2p orbital tiene la energía más baja o más baja n valor y se llenará antes de la 3s shell.
Lectura relacionada:
 Nombres de 10 Bases con Estructuras Químicas y Fórmulas
Nombres de 10 Bases con Estructuras Químicas y FórmulasUso del Principio Aufbau
Probablemente la peor manera de usar el principio de Aufbau para calcular el orden de llenado de los orbitales de un átomo es intentar memorizar el orden por fuerza bruta:
- 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d 7p 8s
Afortunadamente, existe un método mucho más simple para obtener este pedido:
- Escribe una columna de s orbitales del 1 al 8.
- Escriba una segunda columna para el p orbitales que comienzan en n=2. (1p no es una combinación orbital permitida por la mecánica cuántica.)
- Escribe una columna para el d orbitales que comienzan en n=3.
- Escribe una columna final para 4f y 5f. No hay elementos que necesiten un 6f o 7f cáscara para llenar.
- Lea el gráfico ejecutando las diagonales a partir de 1s.
El gráfico muestra esta tabla y las flechas muestran el camino a seguir. Ahora que sabes el orden de los orbitales a llenar, solo necesitas memorizar el tamaño de cada orbital.
Lectura relacionada: Hechos del Hidrógeno-H o Número atómico 1
Hechos del Hidrógeno-H o Número atómico 1- Los orbitales S tienen un valor posible de m para mantener dos electrones.
- Los orbitales P tienen tres valores posibles de m para contener seis electrones.
- Los orbitales D tienen cinco valores posibles de m para contener 10 electrones.
- Los orbitales F tienen siete valores posibles de m para contener 14 electrones.
Esto es todo lo que necesita para determinar la configuración electrónica de un átomo estable de un elemento.
Por ejemplo, tomemos el elemento nitrógeno, que tiene siete protones y, por lo tanto, siete electrones. El primer orbital a llenar es el 1s orbital. Un s el orbital contiene dos electrones, por lo que quedan cinco electrones. El siguiente orbital es el 2s orbital y sostiene los dos siguientes. Los últimos tres electrones irán a la 2p orbital, que puede contener hasta seis electrones.
Lectura relacionada:
 Diferencia Entre Radio Atómico y Radio Iónico
Diferencia Entre Radio Atómico y Radio IónicoProblema de Ejemplo de Configuración Electrónica de Silicio
Este es un problema de ejemplo trabajado que muestra los pasos necesarios para determinar la configuración electrónica de un elemento utilizando los principios aprendidos en las secciones anteriores
Problema
Determina la configuración electrónica del silicio.
Solución
El silicio es el elemento No. 14. Tiene 14 protones y 14 electrones. El nivel de energía más bajo de un átomo se llena primero. Las flechas en el gráfico muestran el s números cuánticos, girar hacia arriba y girar hacia abajo.
- El paso A muestra los dos primeros electrones que llenan el 1s orbital y dejando 12 electrones.
- El paso B muestra los siguientes dos electrones que llenan el 2s orbital dejando 10 electrones. (El 2p orbital es el siguiente nivel de energía disponible y puede contener seis electrones.)
- El paso C muestra estos seis electrones y deja cuatro electrones.
- El paso D llena el siguiente nivel de energía más bajo, 3s con dos electrones.
- El paso E muestra los dos electrones restantes que comienzan a llenar el 3p orbital.
Una de las reglas del principio de Aufbau es que los orbitales se llenan con un tipo de espín antes de que comience a aparecer el espín opuesto. En este caso, los dos electrones de giro ascendente se colocan en las dos primeras ranuras vacías, pero el orden real es arbitrario. Podría haber sido la segunda y la tercera ranura o la primera y la tercera.
Respuesta
La configuración electrónica del silicio es:
1s22s2p63s23p2
Notación y excepciones al Principal de la Aufbau
La notación que se ve en las tablas de períodos para configuraciones electrónicas usa la forma:
nOe
- n es el nivel de energía
- O es el tipo orbital (s, p, d, o f)
- e es el número de electrones en esa capa orbital.
Por ejemplo, el oxígeno tiene ocho protones y ocho electrones. El principio de Aufbau dice que los dos primeros electrones llenarían el 1s orbital. Los dos siguientes llenarían el 2s orbital dejando los cuatro electrones restantes para tomar puntos en el 2p orbital. Esto se escribiría como:
1s22s2p4
Los gases nobles son los elementos que llenan su orbital más grande completamente sin electrones sobrantes. El neón llena el 2p orbital con sus últimos seis electrones y se escribiría como:
1s22s2p6
El siguiente elemento, el sodio, sería el mismo con un electrón adicional en el 3s orbital. En lugar de escribir:
1s22s2p43s1
y tomando una larga fila de texto repetitivo, se usa una notación abreviada:
[Ne]3s1
Cada período utilizará la notación del gas noble del período anterior. El principio Aufbau funciona para casi todos los elementos probados. Hay dos excepciones a este principio, cromo y cobre.
El cromo es el elemento No. 24, y de acuerdo con el principio Aufbau, la configuración electrónica debe ser [Ar]3d4s2. Los datos experimentales reales muestran que el valor es [Ar]3d5s1. El cobre es el elemento No. 29 y debe ser [Ar]3d92s2, pero se ha de determinar que sea [Ar]3d104s1.
El gráfico muestra las tendencias de la tabla periódica y el orbital de mayor energía de ese elemento. Es una excelente manera de verificar sus cálculos. Otro método de verificación es usar una tabla periódica, que incluye esta información.