Si alguna vez te has preguntado cómo se calcula la masa atómica, ya sea en química o física, es importante saber que existen diferentes métodos para encontrarla. El método que uses dependerá de la información con la que cuentes. Antes de empezar, es esencial comprender qué es exactamente la masa atómica.
¿Qué Es La Masa Atómica?
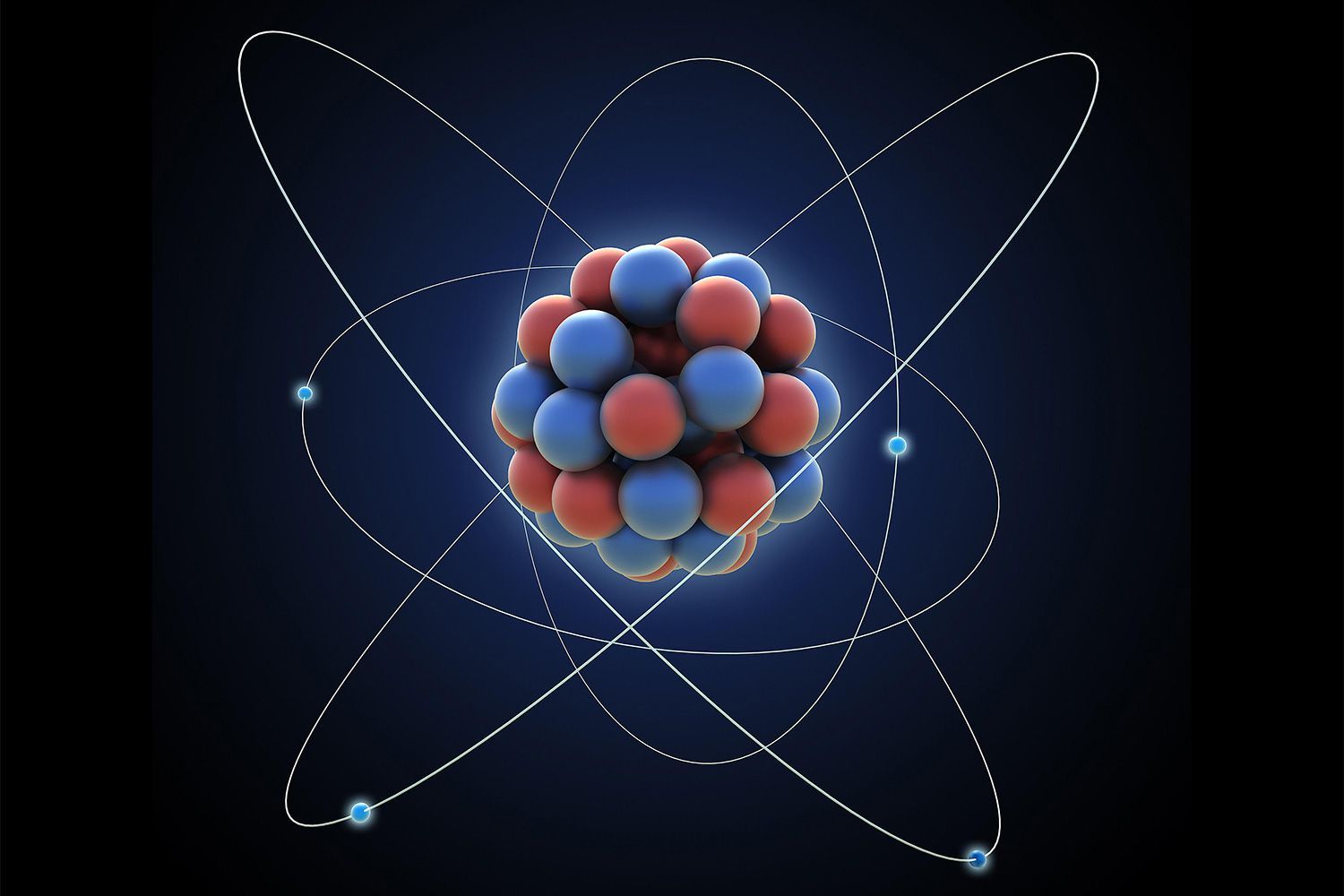
La masa atómica es la suma de las masas de los protones, neutrones y electrones en un átomo, o la masa promedio, en un grupo de átomos. Aunque los electrones tienen mucha menos masa que los protones y neutrones, y no se consideran en el cálculo. Por lo tanto, la masa atómica es básicamente la suma de las masas de protones y neutrones. Dependiendo de tu situación, hay tres maneras de determinarla. La elección del método dependerá de si tienes un solo átomo, una muestra natural del elemento o simplemente necesitas el valor estándar.
Lectura relacionada: Estructura Electrónica y Principio Aufbau
Estructura Electrónica y Principio Aufbau
3 Formas de Encontrar la Masa Atómica
El método utilizado para calcular la masa atómica variará si estás examinando un solo átomo, una muestra natural o una muestra que contiene una proporción conocida de isótopos:
1) Busque la Masa Atómica en la Tabla Periódica
Lectura relacionada: Nombres de 10 Bases con Estructuras Químicas y Fórmulas
Nombres de 10 Bases con Estructuras Químicas y Fórmulas
Para aquellos que se inician en la química, es común que se les enseñe a utilizar la tabla periódica para encontrar la masa atómica de un elemento. Este número generalmente se ubica debajo del símbolo del elemento. Debes identificar el número decimal, que representa un promedio ponderado de las masas atómicas de todos los isótopos naturales del elemento.
Ejemplo: Si se te pide que proporciones la masa atómica del carbono, primero necesitas conocer su símbolo, C. Al buscar C en la tabla periódica, encontrarás un número que corresponde al número atómico del carbono. Este número aumenta a medida que te desplazas por la tabla, pero no es el que buscas. La masa atómica o el peso atómico es el número decimal, cuyo valor es aproximadamente 12.01.
El valor encontrado en la tabla periódica se expresa en unidades de masa atómica o amu, pero para cálculos químicos se suele representar la masa atómica en términos de gramos por mol o g/mol. La masa atómica del carbono sería de 12.01 gramos por mol de átomos de carbono.
Lectura relacionada: Hechos del Hidrógeno-H o Número atómico 1
Hechos del Hidrógeno-H o Número atómico 12) Suma de Protones y Neutrones para un Solo Átomo
Para saber cómo se calcula la masa atómica de un solo átomo de un elemento, simplemente suma la masa de los protones y neutrones.
Ejemplo: Calcule la masa atómica de un isótopo de carbono que posee 7 neutrones. Mirando la tabla periódica, puedes ver que el carbono tiene un número atómico de 6, equivalente a su número de protones. La masa atómica del átomo se obtiene sumando la masa de los protones y neutrones, es decir, 6 + 7, lo que da como resultado 13.
3) Promedio Ponderado de Todos los Átomos de un Elemento
La masa atómica de un elemento es un promedio ponderado de todos sus isótopos, basado en su abundancia natural. Puedes calcular la masa atómica de un elemento siguiendo estos sencillos pasos.
Generalmente, se te proporcionará una lista de isótopos con su masa y abundancia natural, ya sea como un valor decimal o como un porcentaje.
- Multiplica la masa de cada isótopo por su abundancia. Si la abundancia está en porcentaje, divide el resultado por 100.
- Suma estos valores.
Obtendrás como resultado la masa atómica total o el peso atómico del elemento.
Ejemplo: Se te presenta una muestra con 98% de carbono-12 y 2% de carbono-13. ¿Cuál sería la masa atómica relativa del elemento?
Primero, convierte los porcentajes a valores decimales dividiendo cada uno por 100. Así, obtienes 0.98 de carbono-12 y 0.02 de carbono-13. (Sugerencia: Puedes verificar tus cálculos asegurándote de que los decimales sumen 1. 0.98 + 0.02 = 1.00).
Luego, multiplica la masa atómica de cada isótopo por la proporción correspondiente en la muestra:
0.98 x 12 = 11.76
0.02 x 13 = 0.26
Al sumar estos resultados obtienes la masa atómica final:
11.76 + 0.26 = 12.02 g/mol
Es importante destacar que esta masa atómica es ligeramente superior al valor que aparece en la tabla periódica para el carbono. Esto indica que la muestra analizada contiene más carbono-13 de lo habitual, ya que su masa atómica relativa es mayor que la referenciada en la tabla periódica, que también incluye isótopos más pesados, como el carbono-14. Es relevante considerar que los valores en la tabla periódica se refieren específicamente a las proporciones de isótopos en la corteza y atmósfera terrestre, y podrían no corresponder a las proporciones en el manto, el núcleo o en otros planetas.
Asimismo, podrías notar que los valores de masa atómica que figuran para cada elemento en la tabla periódica pueden variar con el tiempo. Esto ocurre cuando se actualiza la estimación de la proporción de isótopos en la corteza terrestre. En las tablas periódicas más actuales, a veces se da un rango de valores en lugar de uno único para la masa atómica.
Para más ejemplos y una comprensión más profunda de cómo se calcula la masa atómica, puedes buscar ejercicios prácticos y ejemplos detallados que te ayudarán a afianzar estos conceptos.