Que Diferencia clave entre homólisis y heterólisis es que la homólisis es la descomposición de un compuesto químico en dos partes químicamente iguales, mientras que la heterólisis es la descomposición de un compuesto químico en dos partes químicamente diferentes.
Podemos usar energías de disociación de enlaces de compuestos químicos para describir los procesos de homólisis y heterólisis. La energía de disociación de enlace es una medida de la fuerza de un enlace químico. Un enlace puede romperse homolítica o heterolíticamente. La energía de disociación de enlace se define como el cambio de entalpía estándar cuando un enlace químico se escinde por homólisis.
CONTENIDO
1. Descripción general y diferencia clave
2. ¿Qué es la homólisis?
3. ¿Qué es la heterólisis?
5. Homólisis frente a heterólisis en forma tabular
6. Resumen
 Diferencia entre rubidio y niobio.
Diferencia entre rubidio y niobio.¿Qué es la homólisis?
La homólisis es la escisión de un enlace químico de tal manera que se forman dos partes químicamente idénticas del compuesto químico. Un enlace químico (enlace covalente) contiene dos electrones. En esta forma de fisión, cada uno de los fragmentos recibe un electrón desapareado. Cuando esta disociación de enlace ocurre en una molécula neutra que tiene un número par de electrones, forma dos radicales libres iguales.

Figura 01: mecanismo general de escisión homolítica
Lectura relacionada: Diferencia entre sustitución de radicales libres y adición de radicales libres
Diferencia entre sustitución de radicales libres y adición de radicales libresLa energía de disociación del enlace homolítico es la cantidad de energía necesaria para disociar un enlace químico a través de la hemólisis. La hemólisis de un enlace químico es la escisión simétrica del enlace que forma dos radicales, no dos iones. Los electrones de enlace entre los átomos se dividen por la mitad y son absorbidos por los dos átomos. Por ejemplo, la escisión homolítica de un enlace sigma forma dos radicales con un electrón desapareado por radical.
¿Qué es la heterólisis?
La heterólisis es la escisión de un enlace químico de tal manera que se forman dos partes químicamente distintas del compuesto químico. La escisión heterolítica es la disociación de un enlace químico y la formación de dos fragmentos diferentes. Un enlace químico (enlace covalente) contiene dos electrones. En esta forma de fisión, un fragmento recibe ambos pares de electrones de enlace mientras que el otro fragmento no recibe ninguno de los electrones de enlace.

 Diferencia entre mica y pigmento.
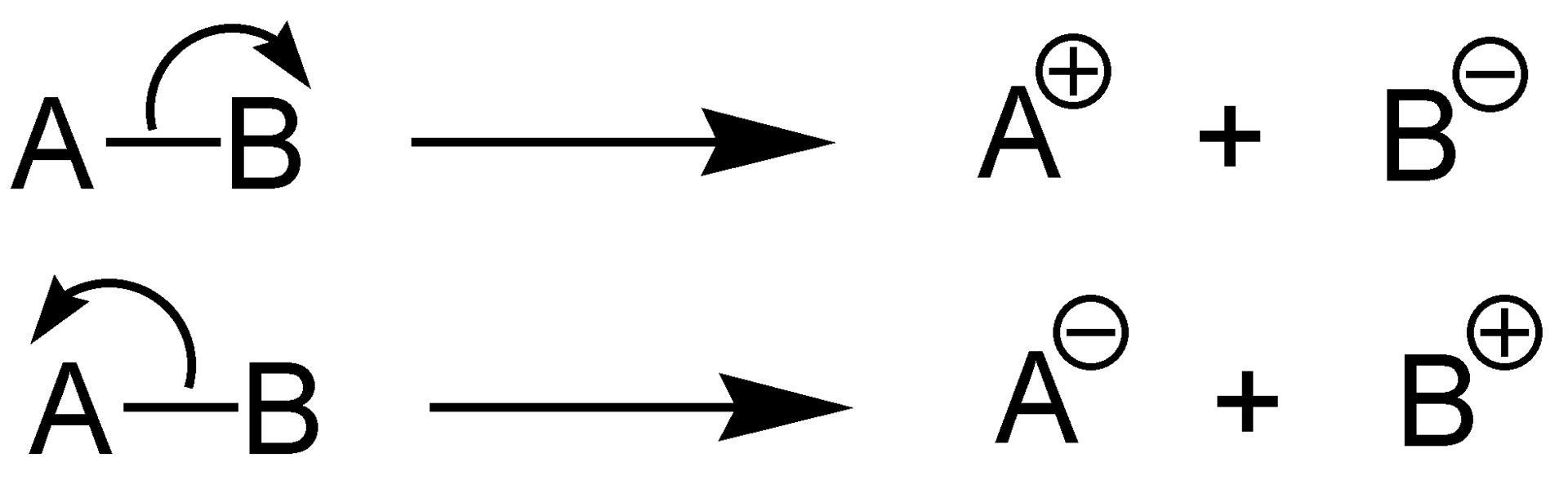
Diferencia entre mica y pigmento.Figura 02: Dos tipos de escisiones heterolíticas.
La energía de disociación de los enlaces heterolíticos es la cantidad de energía necesaria para romper un enlace químico mediante heterólisis. La heterólisis es la ruptura asimétrica de un enlace químico. Durante la heterólisis, se forman cationes y aniones porque en la heterólisis, el par de electrones de enlace es absorbido por el átomo electronegativo (se convierte en el anión), mientras que el otro átomo no acepta electrones (forma el catión).
¿Cuál es la diferencia entre homólisis y heterólisis?
La homólisis y la heterólisis son procesos químicos opuestos. los diferencia principal entre homólisis y heterólisis es que la homólisis es la descomposición de un compuesto químico en dos partes químicamente iguales, mientras que la heterólisis es la descomposición de un compuesto químico en dos partes químicamente diferentes. Además, la energía de disociación del enlace homolítico determina la energía necesaria para que se produzca la homolisis, mientras que la energía de disociación del enlace heterolítico determina la energía necesaria para que se produzca la heterólisis.
Resumen: homólisis frente a heterólisis
La homólisis y la heterólisis son procesos químicos opuestos. los diferencia clave entre homólisis y heterólisis es que la homólisis es la descomposición de un compuesto químico en dos partes químicamente iguales, mientras que la heterólisis es la descomposición de un compuesto químico en dos partes químicamente diferentes.
Relación:
1. "Homólisis". Una visión general | Temas de ScienceDirect.
Imagen de cortesía:
1. "Homólisis (química)" por Jürgen Martens - Jürgen Martens (Dominio público) a través de Commons Wikimedia
2. "Heterólisis (química)" Por Jürgen Martens - Jürgen Martens (CC BY-SA 3.0) a través de Commons Wikimedia