La diferencia clave entre el carbocatión clásico y no clásico es esta Los carbocationes clásicos tienen un átomo de carbono con seis electrones en tres enlaces químicos, mientras que los carbocationes no clásicos tienen una estructura de tres centros y dos electrones.
Un carbocatión es una especie química que es una unidad de una molécula orgánica. Tiene una carga positiva en un átomo de carbono. Un ejemplo simple de un carbocatión es CH3+. Algunos carbocationes tienen más de una carga positiva en el mismo átomo de carbono o en un átomo diferente. Además, debido a la presencia de carga positiva, los carbocationes son intermedios reactivos en reacciones orgánicas; Hay seis electrones en un átomo de carbono, lo que lo hace inestable (la presencia de ocho electrones asegura la estabilidad); por lo tanto, tiende a buscar electrones.
CONTENIDO
1. Descripción general y diferencia clave
2. ¿Qué es el carbocatión clásico?
3. ¿Qué es el carbocatión no clásico?
4. Comparación lado a lado: carbocatión clásico frente a no clásico en forma tabular
5. Resumen
 Diferencia entre MnO2 y CuO
Diferencia entre MnO2 y CuO¿Qué es el carbocatión clásico?
Un carbocatión clásico es un ion que contiene un átomo de carbono con carga positiva que tiene seis electrones involucrados en tres enlaces químicos. Podemos referirnos a este átomo de carbono como un átomo de carbono positivo de tres coordenadas.

Figura 01: Formación de un carbocatión clásico.
Lectura relacionada: Diferencia entre porfirina y protoporfirina.
Diferencia entre porfirina y protoporfirina.Para garantizar la máxima estabilidad, el átomo de carbono debe tener ocho electrones de valencia. Pero en el carbocatión, solo hay seis electrones en el átomo de carbono que tienen una carga positiva. Por lo tanto, tiende a compartir dos electrones más de una especie electronegativa. Esto hace que el átomo de carbono sea estable y neutraliza la carga positiva. Esta es la razón de la alta reactividad de los carbocationes clásicos. Sin embargo, la energía de un carbocatión clásico es pequeña en comparación con la energía del carbocatión no clásico correspondiente. Pero esta diferencia en sus energías es muy pequeña.
¿Qué es el carbocatión no clásico?
Un carbocatión no clásico es un ion que contiene un carbono con carga positiva en un centro de tres centros y dos electrones. Esto significa que en estos carbocationes, tres átomos comparten dos electrones. Este tipo de intercambio de electrones se denomina deslocalización de los electrones.

 Diferencia entre berilio y magnesio.
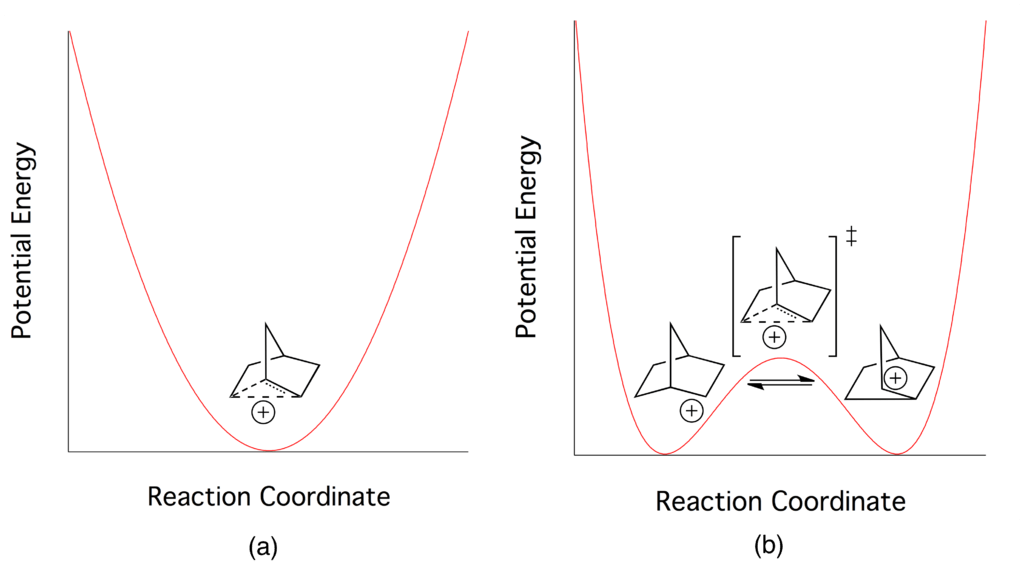
Diferencia entre berilio y magnesio.Figura 02: Diferencia de energía entre carbocationes clásicos y no clásicos.
El ejemplo más común de un carbocatión no clásico es el catión 2-norbornilo. Existe en una estructura menos simétrica de tres centros y dos electrones. Hay muy poca diferencia de energía entre los carbocationes clásicos y no clásicos. Por lo tanto, es muy difícil distinguirlos experimentalmente.
¿Cuál es la diferencia entre carbocatión clásico y no clásico?
Podemos clasificar los carbocationes en dos grupos como carbocationes clásicos y no clásicos según la estructura química. La principal diferencia entre el carbocatión clásico y el no clásico es que el carbocatión clásico tiene un átomo de carbono con seis electrones en tres enlaces químicos, mientras que el carbocatión no clásico tiene una estructura de tres centros y dos electrones. La energía del carbocatión no clásico es mayor que la energía del carbocatión clásico, pero la diferencia entre estas energías es muy pequeña; Por lo tanto, es muy difícil distinguir la diferencia entre estructuras clásicas y no clásicas.
Además, la energía de activación para la transformación del carbocatión clásico en un carbocatión no clásico o viceversa es muy pequeña. Además, los carbocationes clásicos tienen la carga positiva en el átomo de carbono y los pares de electrones nodales alrededor del átomo de carbono, pero en los carbocationes no clásicos los electrones están deslocalizados alrededor del átomo de carbono. Un ejemplo de carbocatión clásico es el ion metenio, mientras que un ejemplo de carbocatión no clásico es el ion 2-norborilo.
Resumen: carbocatión clásico frente a no clásico
Podemos dividir los carbocationes en dos grupos como carbocationes clásicos y no clásicos según la estructura química. La principal diferencia entre el carbocatión clásico y el no clásico es que el carbocatión clásico tiene un átomo de carbono con seis electrones en tres enlaces químicos, mientras que el carbocatión no clásico tiene una estructura de tres centros y dos electrones. Un ejemplo de carbocatión clásico es el ion metenio, mientras que un ejemplo de carbocatión no clásico es el ion 2-norborilo.
Relación:
1. “Carbocationes”. Química LibreTexts, 5 de junio de 2019, disponible aquí.
2. “Carbocatión”. Wikipedia.Org, 2019, disponible aquí.
Imagen de cortesía:
1. "El catión ciclopropil carbinilo" por V8rik en Wikipedia en inglés (CC BY-SA 3.0) a través de Commons Wikimedia
2. "Pozo único de catión norbornilo frente a potencial de pozo doble" por Jcal730 - Trabajo propio (Dominio público) a través de Commons Wikimedia