La principal diferencia entre el éster y el éter es que el El grupo funcional de un éster es -COO, mientras que el grupo funcional de un éter es -O-.
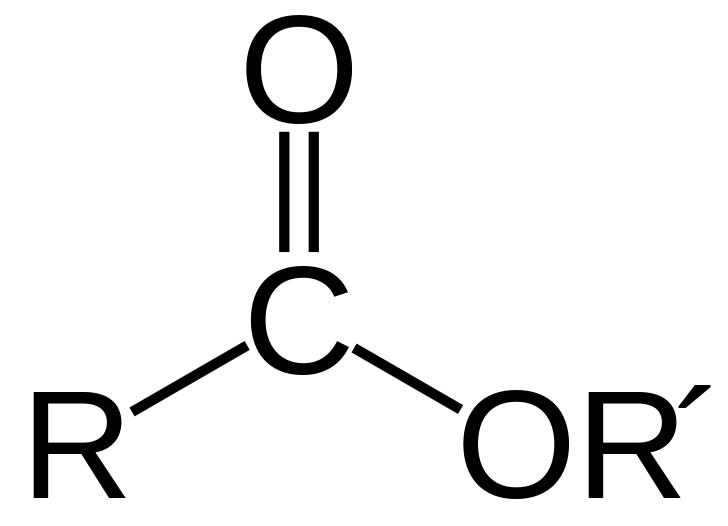
Los ésteres y éteres son moléculas orgánicas con átomos de oxígeno. Los ésteres tienen el grupo -COO. Un átomo de oxígeno está unido al carbono con un enlace doble y el otro átomo de oxígeno está unido al carbono con un enlace simple. Debido a que solo tres átomos están unidos al átomo de carbono, tiene una geometría plana trigonal a su alrededor. Además, el átomo de carbono es sp2 hibridado. Además, un éster es un derivado de ácido carboxílico. Un éter, por otro lado, tiene un átomo de oxígeno con dos enlaces simples con dos grupos alquilo o arilo. El átomo de oxígeno también tiene dos pares solitarios de electrones.
Lectura relacionada: Diferencia entre ácido nítrico fumante y ácido nítrico concentrado
Diferencia entre ácido nítrico fumante y ácido nítrico concentradoCONTENIDO
1. Descripción general y diferencia clave
2. ¿Qué es el éster?
3. ¿Qué es el éter?
4. Comparación lado a lado: éster frente a éter en forma tabular
5. Resumen
¿Qué es el éster?
Un éster es un compuesto orgánico formado por la reacción de un oxoácido con un compuesto hidroxilo (como el alcohol y el fenol). Se parece a un ácido carboxílico donde el átomo de hidrógeno del grupo -COOH ha sido reemplazado por un grupo alquilo o arilo. Los ésteres son moléculas polares, pero sus puntos de ebullición son más bajos que los de los ácidos carboxílicos de peso similar. Esto se debe a que los ésteres no pueden formar enlaces de hidrógeno entre ellos. Sin embargo, pueden formar enlaces de hidrógeno entre sus átomos de oxígeno y los átomos de hidrógeno de las moléculas de agua. Por lo tanto, los ésteres son fácilmente solubles en agua.

 Diferencia entre benceno y ciclohexano.
Diferencia entre benceno y ciclohexano.Figura 01: Estructura general de un éster.
Además, un éster tiene un olor afrutado que difiere del ácido carboxílico correspondiente (los ácidos suelen tener un olor desagradable). De hecho, estos ésteres son la razón por la que muchas frutas huelen; por ejemplo, la piña obtiene su olor del etanoato de etilo. Y este fenómeno ha llevado al uso de ésteres en la industria alimentaria.
Sin embargo, los ésteres que usamos en un producto dado para obtener el olor afrutado que queremos no son los mismos compuestos presentes en la fuente natural. Aún así, los ésteres pueden producir el mismo sabor y olor. Además, aunque el compuesto no es el mismo que en la fruta natural, no es peligroso comer estos productos alimenticios ya que la estructura del éster es muy similar a la del compuesto natural.
Lectura relacionada: Diferencia entre fósforo rojo y blanco.
Diferencia entre fósforo rojo y blanco.que es eter
Un éter es un compuesto orgánico que tiene un átomo de oxígeno unido a dos grupos alquilo o arilo. Podemos referirnos a un éter simple como un éter alquílico porque contienen dos pequeños grupos alquilo unidos a un átomo de oxígeno. En su nomenclatura, debemos listar los grupos alquilo en orden alfabético, agregando el término “éter” al final. Por ejemplo, si un éter tiene un grupo metilo y un grupo n-butilo unido al átomo de oxígeno, lo llamamos "n-butil metil éter".
Los éteres pueden disolver una variedad de compuestos polares y no polares. Esto se debe principalmente a que los éteres no tienen una red de enlaces de hidrógeno que deba romperse para disolver un soluto. Por lo tanto, los compuestos no polares tienden a disolverse mejor en éter dietílico que en alcoholes.

Figura 02: Estructura general de Ether
En la estructura general del éter, el oxígeno tiene un sp3 hibridación, y los dos pares solitarios están en dos orbitales hibridados mientras que dos están involucrados en la unión con grupos R. El ángulo de enlace RO-R' es de aproximadamente 104,5°, que es similar al del agua. Los puntos de ebullición de los éteres son aproximadamente comparables a los de los hidrocarburos del mismo peso molecular, pero los puntos de ebullición de los éteres son más bajos que los de los alcoholes. Aunque los éteres no pueden formar enlaces de hidrógeno dentro de ellos, son capaces de formar enlaces de hidrógeno con otros compuestos como el agua. Por lo tanto, los éteres son solubles en agua, pero la solubilidad puede disminuir dependiendo de la longitud de las cadenas hidrocarbonadas unidas.
¿Cuál es la diferencia entre éster y éter?
Un éster es un compuesto orgánico formado por la reacción de un oxoácido con un compuesto hidroxilo. Un éter, por otro lado, es un compuesto orgánico que tiene un átomo de oxígeno unido a dos grupos alquilo o arilo. La diferencia clave entre el éster y el éter es que el grupo funcional del éster es -COO, mientras que el grupo funcional del éter es -O-. La fórmula química general del éster y el éter es RC(=O)OR' y RO-R', respectivamente. Además, otra diferencia clave entre el éster y el éter es que el éster tiene un grupo carbonilo en su grupo funcional donde el éter no lo tiene.
Más importante aún, los ésteres tienen un olor afrutado mientras que los éteres tienen un fuerte olor etéreo. Por lo tanto, también podemos considerar esto como la diferencia entre éster y éter. Además, los ésteres tienen puntos de ebullición más bajos que los ácidos carboxílicos y alcoholes del mismo peso, mientras que los éteres tienen puntos de ebullición más bajos que los ésteres, ácidos carboxílicos y alcoholes del mismo peso.
Resumen: éster frente a éter
Un éster es un compuesto orgánico formado por la reacción de un oxoácido con un compuesto hidroxilo. Un éter, por otro lado, es un compuesto orgánico que tiene un átomo de oxígeno unido a dos grupos alquilo o arilo. La diferencia clave entre el éster y el éter es que el grupo funcional del éster es -COO, mientras que el grupo funcional del éter es -O-.
Relación:
1. De Rosa, Thomas F. Avances en química orgánica sintética y métodos en patentes estadounidenses. Elsevier, 2006.
2. Ouellette, Robert J. y J. David Rawn. Química orgánica: estructura, mecanismo y síntesis.. Elsevier, 2014.
Imagen de cortesía:
1. "Éster-general" Adoptado por Sakurambo~commonswiki. Trabajo propio asumido (basado en reclamos de derechos de autor), dominio público) a través de Commons Wikimedia
2. "Éter (General)" Aceptado por Benjah-bmm27. Trabajo propio asumido (basado en reclamos de derechos de autor) (Dominio público) a través de Commons Wikimedia