La principal diferencia entre la esterificación y la saponificación es esta. La esterificación forma un éster mientras que la saponificación descompone el éster en sus materiales de partida.
Un éster se forma a partir de un ácido carboxílico y un alcohol. Por tanto, la esterificación es la formación de un éster a partir de un ácido carboxílico y un alcohol. Mientras que la saponificación forma el ácido carboxílico y el alcohol utilizados para hacer el éster.

 Diferencia entre ácidos volátiles y no volátiles.
Diferencia entre ácidos volátiles y no volátiles.CONTENIDO
1. Descripción general y diferencia clave
2. ¿Qué es la esterificación?
3. ¿Qué es la saponificación?
4. Comparación lado a lado: esterificación frente a saponificación en forma tabular
5. Resumen
¿Qué es la esterificación?
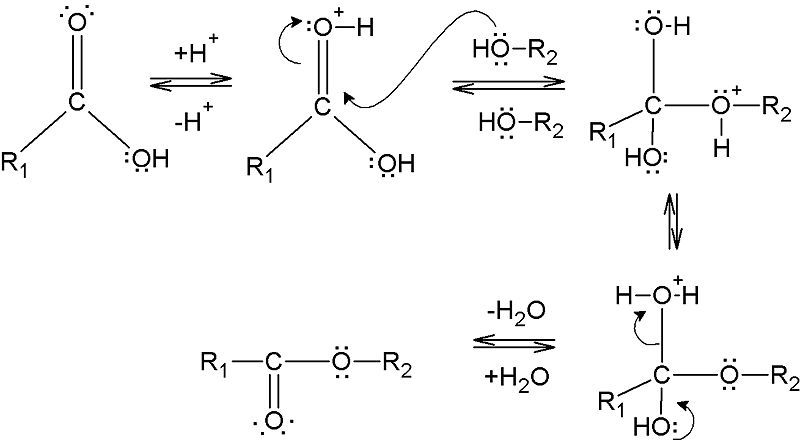
La esterificación es la formación de un éster a partir de la reacción entre un ácido carboxílico y un alcohol. Este proceso requiere un catalizador para reducir la barrera de energía de activación de la reacción. Este catalizador es típicamente un catalizador ácido. Además, la mezcla de reacción debe calentarse porque el proceso de esterificación requiere energía (para escindir el enlace C-OH del ácido carboxílico para eliminar el grupo -OH).

 Diferencia entre acetileno y etileno.
Diferencia entre acetileno y etileno.Figura 1: Formación de un éster por esterificación
El proceso de esterificación implica la eliminación del grupo hidroxilo (-OH) del ácido carboxílico y el átomo de hidrógeno del grupo hidroxilo del alcohol. Durante este proceso, cuando el grupo -OH se elimina del ácido carboxílico, actúa como electrófilo. Y cuando se elimina el protón del alcohol, actúa como un nucleófilo. Por tanto, este nucleófilo ataca al electrófilo formado a partir del ácido carboxílico y forma un éster. Se forma una molécula de agua como subproducto. Entonces, la molécula de agua se forma a partir de la combinación del grupo -OH del ácido carboxílico y el protón del alcohol. Por lo tanto, utilizando un agente deshidratante (para eliminar el agua de la mezcla de reacción) se pueden obtener ésteres puros.
¿Qué es la saponificación?
La saponificación es la descomposición de un éster en un ácido carboxílico y un alcohol. Es lo opuesto a la esterificación. La saponificación tiene lugar en medio acuoso en presencia de una base. Las condiciones básicas del medio hacen que el anión carboxilato sea más estable que la forma de ácido carboxílico. Por lo tanto, la carboxilación se separa del éster. La saponificación se puede hacer sin energía térmica porque no hay barrera energética. Aquí las moléculas de agua en el medio acuoso proporcionan H+ iones, y la base da OH– Iones que se requieren para la formación de alcohol o ácido carboxílico.
Lectura relacionada: Diferencia entre metales de transición y metaloides.
Diferencia entre metales de transición y metaloides.
Figura 2: Proceso general de saponificación
Mecanismo de reacción de la saponificación:
- Ataque nucleófilo
- reordenamiento
- eliminación del grupo saliente
- desprotonación
Los iones hidroxilo (OH–) actúan como nucleófilos porque son ricos en electrones. Estos iones pueden atacar el enlace éster (-COO-) del éster. Atacan el átomo de carbono de este enlace porque el átomo de carbono tiene una carga positiva parcial debido a la presencia de átomos de oxígeno enlazados al átomo de carbono. Entonces el ion OH forma un enlace covalente con el átomo de carbono. Pero el átomo de carbono no puede tener cinco enlaces covalentes porque es un estado de carbono inestable. Por lo tanto, después de la formación de este enlace, tiene lugar un paso de reordenamiento. En el paso de reordenamiento, la eliminación del grupo -OR (derivado del alcohol utilizado para hacer el éster) estabiliza las moléculas. Es el grupo saliente de la reacción de saponificación. La desprotonación del ácido carboxílico tiene lugar ya que la carboxilación es la forma estable en el medio básico.
¿Cuál es la diferencia entre esterificación y saponificación?
Esterificación vs. Saponificación |
|
| La esterificación es la formación de un éster a partir de la reacción entre un ácido carboxílico y un alcohol. | La saponificación es la descomposición de un éster en un ácido carboxílico y un alcohol. |
| demanda de energía | |
| La esterificación requiere energía en forma de calor. | La saponificación no requiere energía externa. |
| reactivos | |
| Los reactivos de la esterificación son alcohol y ácido carboxílico. | Los reactivos de saponificación son éster y base junto con agua. |
| Catalizador | |
| La esterificación requiere un catalizador ácido. | La saponificación requiere un catalizador básico. |
Resumen - Esterificación vs. Saponificación
La esterificación y la saponificación son reacciones químicas importantes en química. La esterificación es la síntesis de éster y la saponificación es la ruptura del enlace éster. los diferencia clave entre esterificación y saponificación es que en el proceso de esterificación se forma un éster mientras que en el proceso de saponificación un éster se descompone en sus materiales de partida.
Relación:
1. Helmenstina, Anne Marie, Ph.D. "Definición y reacción de saponificación". ThoughtCo, 3 de octubre de 2017, disponible aquí.
2. "Saponificación". Wikipedia, Fundación Wikimedia, 3 de abril de 2018, disponible aquí.
3. Esterificación - alcoholes y ácidos carboxílicos. Disponible aquí.
Imagen de cortesía:
1. "Formación de éster" por Laghi.l - Trabajo propio (CC BY-SA 3.0) a través de Commons Wikimedia
2. "SaponificationGenera" por V8rik en Wikipedia en inglés (CC BY-SA 3.0) a través de Commons Wikimedia