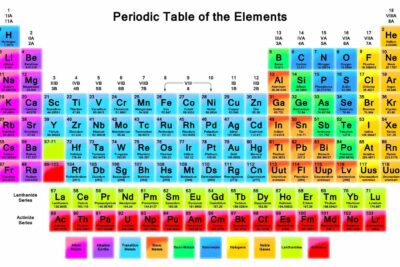
El grupo más grande de elementos son los metales de transición. A continuación, se muestra la ubicación de estos elementos y sus propiedades compartidas.
Qué Es un Metal de Transición?
De todos los grupos de elementos, los metales de transición pueden ser los más confusos de identificar porque existen diferentes definiciones de qué elementos deben incluirse. De acuerdo con la IUPAC, un metal de transición es cualquier elemento con una subcapa de electrones d parcialmente llena. Esto describe los grupos 3 a 12 en la tabla periódica, aunque los elementos del bloque f (lantánidos y actínidos, debajo del cuerpo principal de la tabla periódica) también son metales de transición. Los elementos del bloque d se denominan metales de transición, mientras que los lantánidos y actínidos se denominan "metales de transición internos".
Lectura relacionada: Ver Si la Vitamina C Es un Compuesto Orgánico
Ver Si la Vitamina C Es un Compuesto OrgánicoLos elementos se denominan metales de "transición" porque el químico inglés Charles Bury usó el término en 1921 para describir la serie de elementos de transición, que se refería a la transición de una capa interna de electrones con un grupo estable de 8 electrones a una con 18 electrones o la transición de 18 electrones a 32.
Ubicación de los Metales de Transición en la Tabla Periódica
Los elementos de transición están situados en los grupos IB a VIIIB de la tabla periódica. En otras palabras, los metales de transición son elementos:
Lectura relacionada: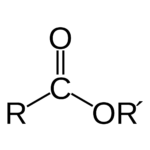 Qué es un Éster en Química?
Qué es un Éster en Química?- 21 (escandio) a 29 (cobre)
- 39 (itrio) a 47 (plata)
- 57 (lantano) a 79 (oro)
- 89 (actinio) a 112 (copernicio), que incluye los lantánidos y actínidos
Otra forma de verlo es que los metales de transición incluyen los elementos del bloque d, además de que muchas personas consideran que los elementos del bloque f son un subconjunto especial de metales de transición. Mientras que el aluminio, el galio, el indio, el estaño, el talio, el plomo, el bismuto, el nihonio, el flerovium, el moscovium y el livermorium son metales, estos "metales básicos" tienen menos carácter metálico que otros metales de la tabla periódica y tienden a no considerarse metales de transición.
Descripción General de las Propiedades de los Metales de Transición
Debido a que poseen las propiedades de los metales, los elementos de transición también se conocen como metales de transición. Estos elementos son muy duros, con altos puntos de fusión y puntos de ebullición. Moviéndose de izquierda a derecha a través de la tabla periódica, los cinco d los orbitales se llenan más. El d los electrones están unidos libremente, lo que contribuye a la alta conductividad eléctrica y maleabilidad de los elementos de transición. Los elementos de transición tienen bajas energías de ionización. Exhiben una amplia gama de estados de oxidación o formas cargadas positivamente. Los estados de oxidación positivos permiten que los elementos de transición formen muchos compuestos iónicos y parcialmente iónicos diferentes. La formación de complejos provoca la d los orbitales se dividen en dos subniveles de energía, lo que permite que muchos de los complejos absorban frecuencias específicas de luz. Por lo tanto, los complejos forman soluciones y compuestos coloreados característicos. Las reacciones de complejación a veces mejoran la solubilidad relativamente baja de algunos compuestos.
Lectura relacionada: Propiedades de los Gases Nobles
Propiedades de los Gases Nobles
Resumen Rápido de las Propiedades de los Metales de Transición
- Bajas energías de ionización
- Estados de oxidación positivos
- Múltiples estados de oxidación, ya que hay una brecha de baja energía entre ellos
- Muy duro
- Exhibir brillo metálico
- Altos puntos de fusión
- Altos puntos de ebullición
- Alta conductividad eléctrica
- Alta conductividad térmica
- Maleable
- Formar compuestos coloreados, debido a transiciones electrónicas d-d
- Cinco d los orbitales se llenan más, de izquierda a derecha en la tabla periódica
- Típicamente forman compuestos paramagnéticos debido a los electrones d desapareados
- Típicamente exhiben una alta actividad catalítica