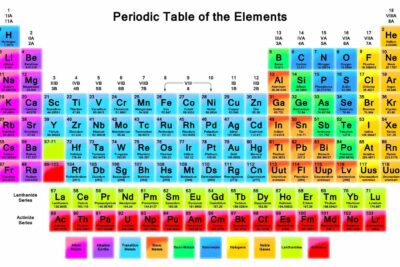
La columna derecha de la tabla periódica contiene siete elementos conocidos como el inerte o gases nobles. Conozca las propiedades del grupo de elementos de los gases nobles.
Conclusiones Clave: Propiedades de los Gases Nobles
- Los gases nobles son el grupo 18 en la tabla periódica, que es la columna de elementos en el lado derecho de la tabla.
- Hay siete elementos de gas noble: helio, neón, argón, criptón, xenón, radón y oganesson.
- Los gases nobles son los elementos químicos menos reactivos. Son casi inertes porque los átomos tienen una capa de electrones de valencia completa, con poca tendencia a aceptar o donar electrones para formar enlaces químicos.
Entre las 3 características de los gases nobles que los destacan se encuentran su falta de color, olor y su no inflamabilidad. Estas características, junto con su baja reactividad, hacen de los gases nobles elementos únicos en la tabla periódica.
Lectura relacionada:
 Denominación de Grupos Funcionales de Cadena Alquílica Simple
Denominación de Grupos Funcionales de Cadena Alquílica SimpleUbicación y lista de los Gases Nobles en la Tabla Periódica
Los gases nobles, también conocidos como gases inertes o gases raros, se encuentran en el Grupo VIII o en el grupo 18 de la Unión Internacional de Química Pura y Aplicada (IUPAC) de la tabla periódica. Esta es la columna de elementos a lo largo del extremo derecho de la tabla periódica. Este grupo es un subconjunto de los no metales. Colectivamente, los elementos también se denominan grupo helio o grupo neón. Los gases nobles son:
- Helio (He)
- Neón (Ne)
- Argón (Ar)
- Criptón (Kr)
- Xenón (Xe)
- Radón (Rn)
- Oganesson (Og)
Con la excepción de oganesson, todos estos elementos son gases a temperatura y presión ordinarias. No se han producido suficientes átomos de oganesson para conocer con certeza su fase, pero la mayoría de los científicos predicen que será líquida o sólida.
Tanto el radón como el oganesson consisten solo en isótopos radiactivos.
Lectura relacionada: Definición de Punto de Equivalencia
Definición de Punto de Equivalencia
Propiedades de los Gases Nobles
Los gases nobles son relativamente no reactivos. De hecho, son los elementos menos reactivos de la tabla periódica. Esto se debe a que tienen una capa de valencia completa. Tienen poca tendencia a ganar o perder electrones. En 1898, Hugo Erdmann acuñó la frase "gas noble" para reflejar la baja reactividad de estos elementos, de la misma manera que los metales nobles son menos reactivos que otros metales. Los gases nobles tienen altas energías de ionización y electronegatividades insignificantes. Los gases nobles tienen puntos de ebullición bajos y son todos gases a temperatura ambiente.
Resumen de Propiedades Comunes
Lectura relacionada: Elementos Monoatómicos o Monoatómicos
Elementos Monoatómicos o Monoatómicos- Bastante no reactivo
- Capa externa completa de electrones o valencia (número de oxidación = 0)
- Altas energías de ionización
- Electronegatividades muy bajas
- Puntos de ebullición bajos (todos los gases monoatómicos a temperatura ambiente)
- Sin color, olor o sabor en condiciones normales (pero puede formar líquidos y sólidos coloreados)
- No Inflamable
- A baja presión, conducirán electricidad y fluorescerán
Refiriéndonos a las 5 características de los gases nobles, podríamos agregar a la lista anterior que bajo ciertas condiciones experimentales, algunos gases nobles pueden formar compuestos, lo que demuestra que, aunque su reactividad es minimalista, no es inexistente.
Usos de los Gases Nobles
Los gases nobles se usan para formar atmósferas inertes, típicamente para soldadura por arco, para proteger muestras y para disuadir reacciones químicas. Los elementos se utilizan en lámparas, como luces de neón y faros de criptón, y en láseres. El helio se utiliza en globos, para tanques de aire de buceo en aguas profundas y para enfriar imanes superconductores.
Conceptos Erróneos Sobre los Gases Nobles
Aunque los gases nobles han sido llamados gases raros, no son particularmente infrecuentes en la Tierra o en el universo. De hecho, el argón es el tercer o cuarto gas más abundante en la atmósfera (1,3 por ciento en masa o 0,94 por ciento en volumen), mientras que el neón, el criptón, el helio y el xenón son oligoelementos notables.
Durante mucho tiempo, muchas personas creyeron que los gases nobles eran completamente no reactivos e incapaces de formar compuestos químicos. Aunque estos elementos no forman compuestos fácilmente, se han encontrado ejemplos de moléculas que contienen xenón, criptón y radón. A alta presión, incluso el helio, el neón y el argón participan en las reacciones químicas.
Fuentes de los Gases Nobles
El neón, el argón, el criptón y el xenón se encuentran en el aire y se obtienen licuándolo y realizando destilación fraccionada. La principal fuente de helio es la separación criogénica de gas natural. El radón, un gas noble radiactivo, se produce a partir de la desintegración radiactiva de elementos más pesados, como el radio, el torio y el uranio. El elemento 118 es un elemento radiactivo artificial, producido al golpear un objetivo con partículas aceleradas. En el futuro, se pueden encontrar fuentes extraterrestres de gases nobles. El helio, en particular, es más abundante en planetas más grandes que en la Tierra.
Fuentes
- Greenwood, N. N.; Earnshaw, A. (1997). Química de los Elementos (2ª ed.). Oxford: Butterworth-Heinemann. ISBN 0-7506-3365-4.
- Lehmann, J. (2002). "La química del Criptón". Revisiones de Química de Coordinación. 233–234: 1–39. doi:10.1016/S0010-8545(02)00202-3
- Ozima, Minoru; Podosek, Frank A. (2002). Geoquímica de Gases Nobles. Cambridge University Press. ISBN 0-521-80366-7.
- Partington, J. R. (1957). "Descubrimiento del radón". Naturaleza. 179 (4566): 912. doi:10.1038/179912a0
- Renouf, Edward (1901). "Gases nobles". Ciencia. 13 (320): 268–270.