La titulación es una técnica de química analítica utilizada para encontrar una concentración desconocida de un analito (el valorante) al hacerlo reaccionar con un volumen y concentración conocidos de una solución estándar (llamada valorante). Las valoraciones se usan típicamente para reacciones ácido-base y reacciones redox.
Aquí hay un problema de ejemplo que determina la concentración de un analito en una reacción ácido-base:
Lectura relacionada:
 Composición elemental del Cuerpo Humano por Masa
Composición elemental del Cuerpo Humano por MasaSolución Paso a Paso del Problema de Titulación
Se titula una solución de 25 ml de NaOH 0,5 M hasta que se neutraliza en una muestra de 50 ml de HCl. ¿Cuál fue la concentración del HCl?
Paso 1: Determinar [OH-]
Cada mol de NaOH tendrá un mol de OH-. Por lo tanto [OH-] = 0,5 M.
Lectura relacionada: Consejos e Ideas para Proyectos de la Feria de Ciencias de Cristal
Consejos e Ideas para Proyectos de la Feria de Ciencias de CristalPaso 2: Determinar el número de moles de OH-
Molaridad = número de moles / volumen
Número de moles = Molaridad x Volumen
Lectura relacionada: Definición y Química Cerámica
Definición y Química Cerámica
Número de moles OH- = (0,5 M) (0,025 L)
Número de moles OH- = 0,0125 moles
Paso 3: Determinar el número de moles de H+
Cuando la base neutraliza el ácido, el número de moles de H+ = el número de moles de OH-. Por lo tanto, el número de moles de H+ = 0,0125 moles.
Paso 4: Determinar la concentración de HCl
Cada mol de HCl producirá un mol de H+; por lo tanto, el número de moles de HCl = número de moles de H+.
Molaridad = número de moles / volumen
Molaridad de HCl = (0,0125 mol) / (0,05 L)
Molaridad de HCl = 0,25 M
Respuesta
La concentración del HCl es de 0,25 M.
Otro Método de Solución
Los pasos anteriores se pueden reducir a una ecuación:
MácidoVácido = MbaseVbase
dónde
Mácido = concentración del ácido
Vácido = volumen del ácido
Mbase = concentración de la base
Vbase = volumen de la base
Esta ecuación funciona para reacciones ácido / base donde la relación molar entre ácido y base es 1:1. Si la relación fuera diferente, como en Ca (OH)2 y HCl, la relación sería de 1 mol de ácido a 2 moles de base. La ecuación ahora sería:
MácidoVácido = 2MbaseVbase
Para el problema de ejemplo, la relación es 1: 1:
MácidoVácido = MbaseVbase
Mácido(50 ml)= (0,5 M) (25 ml)
Mácido = 12,5 ml / 50 ml
Mácido = 0,25 M
Error en los Cálculos de Valoración
Se utilizan diferentes métodos para determinar el punto de equivalencia de una valoración. No importa qué método se utilice, se introduce algún error, por lo que el valor de concentración es cercano al valor verdadero, pero no exacto. Por ejemplo, si se usa un indicador de pH coloreado, puede ser difícil detectar el cambio de color. Por lo general, el error aquí es ir más allá del punto de equivalencia, dando un valor de concentración que es demasiado alto.
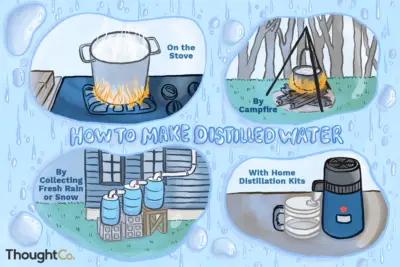
Otra fuente potencial de error cuando se usa un indicador ácido-base es si el agua usada para preparar las soluciones contiene iones que cambiarían el pH de la solución. Por ejemplo, si se usa agua corriente dura, la solución de partida sería más alcalina que si el disolvente hubiera sido agua desionizada destilada.
Si se utiliza un gráfico o una curva de valoración para encontrar el punto final, el punto de equivalencia es una curva en lugar de un punto agudo. El punto final es una especie de "mejor suposición" basada en los datos experimentales.
El error se puede minimizar usando un medidor de pH calibrado para encontrar el punto final de una valoración ácido-base en lugar de un cambio de color o extrapolación de un gráfico.