¿Qué es el arsénico?
Arsénico es el elemento químico del grupo-15 o grupo nitrogenado de la tabla periódica con el símbolo Como y número atómico 33. De los elementos del grupo 15, el nitrógeno es un componente esencial de los aminoácidos y el fósforo es esencial para los huesos, pero el arsénico es altamente tóxico o venenoso.
La contaminación por arsénico es un grave problema de salud humana que causa cáncer y lesiones en la piel en varios países del mundo. El contenido habitual de arsénico en el agua potable es de 10 ppb, pero superior al nivel normal que se encuentra en las diferentes regiones del mundo.
Lectura relacionada: Plomo, propiedades, símbolo, extracción, hechos, uso
Plomo, propiedades, símbolo, extracción, hechos, usoSe utiliza ampliamente en varios diodos emisores de luz y ventanas láser.
envenenamiento por arsénico
El envenenamiento por arsénico ocurre debido a los altos niveles de As en nuestro cuerpo. La naturaleza tóxica del As en el suelo y el agua se conoce desde muy temprano.
Las tres acciones bioquímicas principales del arsénico son la coagulación de proteínas, la formación de complejos con enzimas y la interferencia con la fosforilación (un paso importante para la generación de ATP).
Lectura relacionada: Galio: símbolo, propiedades, hechos y uso
Galio: símbolo, propiedades, hechos y uso- El envenenamiento por arsénico a corto plazo causa problemas como vómitos, dolor abdominal, encefalopatía y diarrea.
- El envenenamiento a largo plazo es el más peligroso para nuestra salud. Puede causar cáncer, enfermedades del corazón, diabetes y piel oscura.
La razón más común para la exposición a largo plazo es el agua potable que contiene altos niveles de As.
prevención
- Marque el área como insegura donde el contenido de arsénico en el agua subterránea es alto.
- Usando un kit de prueba de arsénico digital para identificar la zona segura para el agua potable.
- Mediante el uso de filtros de agua en los hogares para reducir el contenido de arsénico del agua potable.
- Tenga cuidado al recolectar agua de lluvia.
- Reducir el uso de pesticidas que contienen altos niveles de As.
Contaminación de las aguas subterráneas con arsénico
La fuente de As en el agua subterránea es ciertamente natural en algunas partes del mundo. La contaminación también aumenta por la extracción de metales o el uso de pesticidas agrícolas.
El arsénico en el agua subterránea está mucho más presente en el largo país de Bengala Occidental y Bangladesh. Más de 800.000 personas de estas áreas beben agua contaminada con arsénico.
Lectura relacionada: Platino, Símbolo, Historia, Propiedades, Uso, Producción
Platino, Símbolo, Historia, Propiedades, Uso, ProducciónLa contaminación por arsénico en las aguas subterráneas no es exclusiva de Bengala Occidental y Bangladesh. Se han informado muchos casos en Taiwán, Chile, el norte de México y Argentina. Se han informado otros incidentes menores de contaminación por arsénico en aguas subterráneas en los EE. UU., Canadá, Nueva Zelanda, Japón, etc.
¿Dónde se encuentra el arsénico?
Se encuentra muy bajo, menos de 2 ppm en la corteza terrestre. Ocurre principalmente como sulfuros tales como rejalgar (como4s2), oropimente (como2s3) y arseniuros metálicos como niccolita (NiAs), cobaltita (CoAsS), etc.
Arsenolita (como2O3) también está ampliamente distribuido en todo el mundo. El oropimente y el rejalgar son comunes en la morrena del glaciar Shunkalpa en las montañas Kumaon.
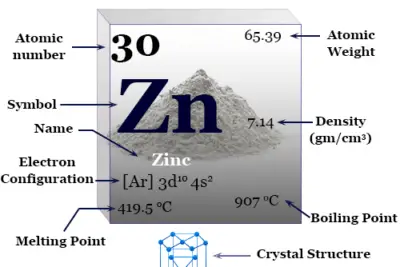
Propiedades del arsénico
Como, Sb y Bi contienen tetrámeros. La rápida condensación de vapor formó una M amarilla inestable4 unidad. Los tres elementos son sólidos quebradizos con colores que van desde el gris acero (As) hasta el blanco azulado (Sb) y el blanco opaco (Bi).
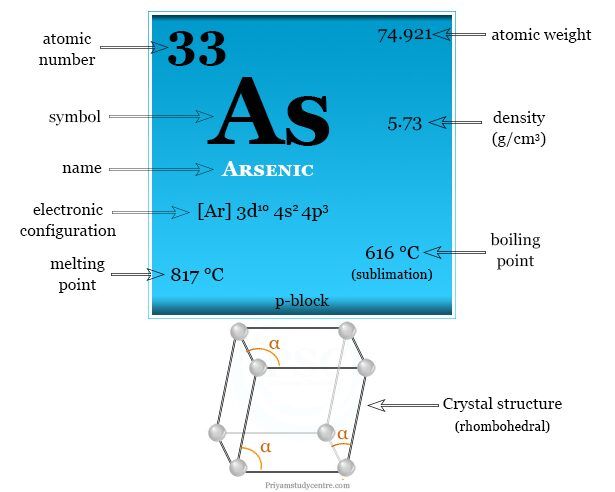
| Arsénico |
|||
| Símbolo | Como | ||
| Descubrimiento | Descubierto por Albertus Magnus alrededor de 1250 | ||
| Nombre derivado de | Arsenikon, el nombre griego para el oropimente pigmento amarillo | ||
| alótropos | Amarillo, gris y negro como | ||
| Isótopo clave | 75Como | ||
| Propiedades periódicas | |||
| número atómico | 33 | ||
| Peso atomico | 74,921 | ||
| Apariencia | gris metalizado | ||
| electrón por escala | 2, 8, 18, 5 | ||
| Configuración electrónica | [Ar] 3d10 4s2 4p3 | ||
| Grupo | 15 | ||
| Período de tiempo | 4 | ||
| Bloquear | bloque p | ||
| Características físicas | |||
| Apariencia | |||
| Densidad (g/cm3) | para fijo | para líquido | |
| 5.73 | 5.22 | ||
| Condición a 20 °C | firma | ||
| Punto de fusion | 817 ºC | ||
| Punto de ebullición | 616 °C (sublimación) | ||
| Temperatura crítica | 1673 K | ||
| estructura cristalina | romboédrico | ||
| Propiedades químicas | |||
| Radio atómico (sin consolidar) | 1.85 | ||
| Radio covalente | 1.20 | ||
| Número de oxidación común | −3, +3, +5 | ||
| Capacidad calorífica molar | 24,64 J mol−1 k−1 | ||
| Electronegatividad | 2,18 según la escala de Pauling | ||
| Afinidad electronica | 77.574 kJ mol−1 | ||
| Energía de ionización (kJ/mol) | 1º | 2do | 3ro |
| 947.0 | 1798 | 2735 | |
| número CAS | 7440-38-2 | ||
Tiene una electronegatividad y una energía de ionización similares a las del fósforo. Forma enlace covalente con la mayoría de los no metales. Los elementos también forman una amplia variedad de compuestos binarios con cada elemento metálico.
como en la tabla periodica
El arsénico ocurre en el período 4 y el grupo 15 o grupo de nitrógeno de la tabla periódica.

Es un elemento del bloque p que se encuentra entre el fósforo y el antimonio en la tabla periódica.
Proceso de producción
Se obtiene tostando minerales de arsenopirita en ausencia de aire y condensando el sublimado. Algo de As queda atrapado en el residuo de sulfuro.
4 FeAsS → 4 FeS + As4(gramo)
Se convierte en As volátil2O3 brindando al aire. El polvo de humo de plomo y cobre obtenido de sus minerales sulfurados es otra fuente de As2O3. Se puede reducir al elemento por reducción de carbono.
2 si2O3 + 6 C → 4 Si + 6 CO
¿Cuáles son los usos del arsénico?
- Los compuestos de arsénico se utilizaron ampliamente a principios del siglo XX para controlar malezas y plagas debido a su toxicidad. En 1980 se prohibieron todos los pesticidas de arseniato debido a las propiedades cancerígenas del As.
- Todavía se usa para conservar la madera y para hacer tipos especiales de vidrio.
- En medicina, el medicamento a base de arsénico Salvarsan se usaba para tratar la sífilis hasta que se descubrió la penicilina.
- Hoy en día, el trióxido de arsénico es muy eficaz para el tratamiento de la leucemia promielocítica.
- El arsénico elemental se usa para hacer varias aleaciones con plomo. Su presencia aumenta la fluidez, brillo, resistencia y dureza de las aleaciones.
- En la actualidad, el GaAs y el InAs se utilizan en gran medida como diodos emisores de luz (LED) y ventanas láser.