
¿Qué es el galio?
Galio es un elemento químico del bloque p o un metal plateado blando del grupo 13 de la tabla periódica con número atómico 31 y símbolo Vamos. El uso de galio ha aumentado significativamente en los últimos años debido al desarrollo de la tecnología de semiconductores. Se encuentra más comúnmente en minerales de sulfuro que contienen zinc.

Entre los elementos del grupo 13, el punto de fusión extremadamente alto del boro indica que tiene una fuerza de unión muy fuerte. El aluminio es relativamente blando. El galio es líquido en un amplio rango de temperatura y se usa en termoquímica a altas temperaturas.
Lectura relacionada: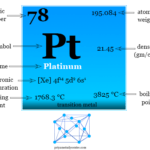 Platino, Símbolo, Historia, Propiedades, Uso, Producción
Platino, Símbolo, Historia, Propiedades, Uso, Producción¿Quién descubrió el galio?
En 1870, Mendeleev hizo maravillosas predicciones sobre el galio y lo denominó eka-aluminio.
En 1875, el químico francés Paul-Émile Lecoq de Boisbaudran descubrió o aisló el elemento de una mezcla de zinc crudo. El nombre de galio se le dio en honor a Francia (nombre latino Gallia).
Galio en la tabla periódica
El elemento se coloca en el período-4 y el grupo-13 en la tabla periódica. Es un elemento de bloque p que se encuentra entre el aluminio y el indio.
Lectura relacionada: Molibdeno, Símbolo, Propiedades, Recursos, Uso
Molibdeno, Símbolo, Propiedades, Recursos, Uso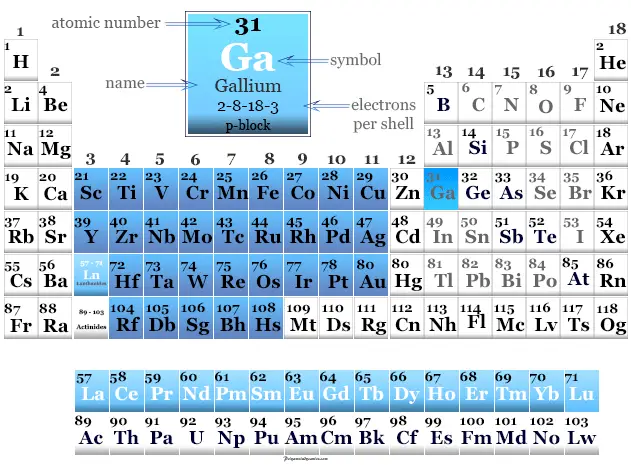
Propiedades del galio
Es un metal de bajo punto de fusión, suave, plateado brillante. El bajo punto de fusión del Ga no tiene una explicación sencilla. Puede ser explicado por el relleno d10 configuración. Pero el punto de ebullición del Ga no es inferior al del Al. Por lo tanto, tiene el alcance de fluido más largo de cualquier elemento.
Lectura relacionada: ¿Qué es el circonio? Símbolo, Propiedades, Conexiones, Uso
¿Qué es el circonio? Símbolo, Propiedades, Conexiones, UsoDebido a la capa protectora de óxido, no se ve afectado por el agua. Ga se disuelve en ácido clorhídrico acuoso a través de un Ga. Dar forma+3 ion. Apenas se ve afectado por el ácido sulfúrico diluido, pero el ácido sulfúrico concentrado se reduce a dióxido de azufre. El ácido nítrico diluido y concentrado formó una capa protectora sobre la superficie del metal.
| Galio |
|||
| Símbolo | Vamos | ||
| Descubrimiento | Paul-Émile Lecoq de Boisbaudran en 1875 | ||
| Nombre derivado de | El nombre latino de France Gallia | ||
| isótopo común | 31Vamos69 | ||
| Propiedades periódicas | |||
| número atómico | 31 | ||
| Peso atomico | 69.723 | ||
| electrón por escala | 2, 8, 18, 3 | ||
| Configuración electrónica | [Ar] 3d10 4s2 4p1 | ||
| Grupo | 13 | ||
| Período de tiempo | 4 | ||
| Bloquear | bloque p | ||
| Punto de fusion | 29,76 ºC | ||
| Punto de ebullición | 2400 °C | ||
| Espesor | 5,91 g/cm23 | ||
| Capacidad calorífica molar | 25,86 J mol−1 k−1 | ||
| Resistencia eléctrica | 270nm | ||
| estructura cristalina | ortorómbico | ||
| Propiedades químicas | |||
| Radio atómico (sin consolidar) | 1.87 | ||
| Radio covalente | 1.23 | ||
| Número de oxidación común | +3 | ||
| Afinidad electronica | 41,49 kJ mol−1 | ||
| Electronegatividad | 1,81 (escala de Pauling) | ||
| Energía de ionización (kJ/mol) |
1º | 2do | 3ro |
| 578.8 | 1979.3 | 2963 | |
| número CAS | 7440-55-3 | ||
¿Dónde se encuentra el galio?
El galio es mucho menos común en la Tierra que el aluminio. Se asocia con aluminio, carbón y minerales sulfurados de zinc y germanio.
Anteriormente, se obtenía del polvo volador que se liberaba al quemar carbón o al tostar minerales sulfurados. Ahora se obtiene como subproducto en la industria del aluminio.
Proceso de producción
Anteriormente, se extraía de cenizas de carbón o electrólisis de sales de galio.
- En la actualidad, el galio se produce como subproducto de la extracción de aluminio. Ga(OH)3 es un ácido más fuerte que el Al(OH)3 debido a la mayor fuerza de polarización eléctrica del Ga+3 ion.
- galato de sodio (Na3GaO3) se obtiene durante la purificación de bauxita por el proceso Bayer.
- La solución que contiene galato de sodio es la electrólisis para obtener el metal.
- El galio de alta pureza que se utiliza en los semiconductores se obtiene mediante un tratamiento químico adicional seguido de un refinado por zonas.
Datos interesantes sobre el galio.
El miembro medio Ga del grupo-13 difiere notablemente del primer miembro del grupo-13.
- Muestra mayor reactividad química a temperaturas moderadas.
- El galio tiene una química catiónica distinta en soluciones acuosas.
- No tiene una serie de hidruros volátiles y compuestos de racimo como boranos y carboranos.
Ingredientes químicos
óxido de galio
El óxido de Ga (III) es el compuesto químico del metal con la fórmula molecular Ga2O3. A altas temperaturas formó α-Ga2O3y a bajas temperaturas formó γ-Ga2O3.
Se utiliza como intermediario para la purificación del metal Ga.
hidruro de galio
Hidruro de galio (GaH3) es similar a la de AlH3 pero es térmicamente menos estable. La viscosidad de GaH3 es muy alto, que se descompone completamente al elemento libre a temperatura ambiente.
Actúa como un ácido de Lewis. Se puede preparar haciendo reaccionar galanato de litio (LiGaH4) con cloruro de galio(III) a -30 °C.
3 LiGaH4 + GaCl3 → 3 LiCl + 4 GaH3.
Cloruro de Ga(III)
El cloruro de Ga(III) es una red cristalina volátil que contiene moléculas diméricas con la fórmula molecular GaH3. Se prepara calentando metal en cloro atmosférico o gas HCl.
GaH3 forma largas agujas blancas que humean debido a la formación de HCl por hidrólisis en el aire húmedo. La forma dimérica de GaH3 se forma por debajo de 600°C. El cloruro de Ga(III) es un catalizador químico eficiente que convierte el AlCl3 para algunos procesos de síntesis de hidrocarburos.
Sulfato de Ga(III)
El sulfato de Ga (III) es el compuesto químico del galio con la fórmula molecular Ga2(ASI QUE4)3o ir2(ASI QUE4)3xH2O. La forma cristalina como Ga2(ASI QUE4)318H2El O se obtiene disolviendo galio metálico en una solución diluida de ácido sulfúrico.
Usos del galio
- En los últimos años, el uso de galio ha aumentado considerablemente debido al desarrollo de la tecnología de semiconductores.
- Los GaAs se utilizan en gran medida en diodos emisores de luz o LED. Dichos tipos de LED se conocen en calculadoras de bolsillo y dispositivos de visualización de salida similares.
- Puede convertir electricidad directamente en luz coherente o diodos láser.
- El galio metálico también se utiliza para fabricar diodos emisores de infrarrojos, detectores de infrarrojos y tubos fotomultiplicadores. GaAs1xpagsX ahora prácticamente dominaba el mercado LED.
- Es muy útil en termómetros de alta temperatura, barómetros, productos farmacéuticos y otras pruebas de medicina nuclear.
- Se utiliza en sellos líquidos de alta temperatura, soldaduras de baja temperatura, fluidos manométricos y medios de transferencia de calor.












