
¿Qué es el cadmio?
Cadmio es un elemento químico del grupo 12 metal en la tabla periódica con el símbolo CD y número atómico 48. Es un metal blando de color blanco plateado químicamente similar al del miembro del grupo zinc y mercurio. Es ampliamente utilizado en el revestimiento de cadmio del acero para evitar la corrosión y en las baterías recargables fabricadas con celdas de níquel cadmio. El uso de cadmio generalmente está disminuyendo debido a su naturaleza tóxica.

Los elementos Zn, Cd y Hg son los últimos miembros de cada serie d pero no tienen características de metales de transición. Estos elementos contienen orbitales d llenos y no muestran números o estados de oxidación variables, color que surge de la unión dd y complejos paramagnéticos.
Lectura relacionada: Rutenio - Elemento, Precio, Uso, Hechos
Rutenio - Elemento, Precio, Uso, HechosEl cadmio fue descubierto en 1817 por los químicos alemanes Stromeyer y Hermann a partir de una impureza en el carbonato de zinc. El nombre del metal se deriva de la palabra latina cadmia que se deriva del nombre mineral calamina.
¿Dónde se encuentra el cadmio?
Una pequeña cantidad de Cd se encuentra en la mayoría de los suelos y rocas, carbón y fertilizantes minerales. Los minerales de cadmio suelen estar combinados con otros elementos como el oxígeno, el cloro o el azufre.
El cadmio generalmente se encuentra en combinación con zinc, pero también rara vez se encuentra en el mineral de sulfuro greenockita (CdS). Un alto nivel de cadmio producido en todo el mundo se obtiene de China, Corea del Sur, Japón y América del Norte. La mayor parte del cadmio producido comercialmente se obtiene como subproducto durante la refinación del zinc.
Lectura relacionada: Iterbio - Elemento, Uso, Hechos
Iterbio - Elemento, Uso, HechosEl elemento cancerígeno cadmio todavía se puede encontrar en productos domésticos cotidianos, como juguetes de plástico de segunda mano, vasos, botellas de bebidas alcohólicas, cerámica y diversas pinturas.
Proceso de producción
El cadmio se presenta invariablemente como una impureza en el zinc y el metal se recupera como subproducto de la producción de zinc.
- Los dos elementos tienen diferencias razonables en el punto de ebullición. Por lo tanto, el Cd se puede separar del Zn por destilación fraccionada.
- El zinc es más electropositivo que el cadmio. Por lo tanto, el cadmio también se puede precipitar de una solución de Cd(II) con zinc metálico.
CD+2 + Zn → Cd + Zn+2 - Los potenciales estándar de Zn y Cd son diferentes. Por lo tanto, durante la electrólisis de una solución de sulfato de zinc lograda con Cd, se puede depositar Cd puro sobre el cátodo antes que cualquier depósito de Zn.
isótopos
El cadmio tiene ocho isótopos naturales con masas atómicas 106, 108, 110, 111, 112, 113, 114 y 116. Entre estos, los tres isótopos son 110CD, 111disco compacto, y 112Los CD son estables pero 113disco compacto y 116Los CD son radiactivos. Los tres isótopos naturales restantes (106CD, 108disco compacto, y 114Se espera que Cd) provoque una desintegración radiactiva, pero no se ha realizado en condiciones de laboratorio.
Lectura relacionada: Erbio - Elemento, Símbolo, Uso, Hechos
Erbio - Elemento, Símbolo, Uso, HechosSe han producido muchos otros isótopos radiactivos de Cd mediante diversas reacciones nucleares artificiales. De estos isótopos radiactivos, los más estables son: 109disco compacto y 115CD. La vida media de la mayoría de estos isótopos radiactivos es inferior a 5 minutos. El principal modo de descomposición de los isótopos de Cd es la captura de electrones para producir plata y la emisión beta para producir indio.
Propiedades
El cadmio es un metal plateado brillante con un tinte azulado y puede empañarse en el aire húmedo. Forma una red cristalina de metal empaquetada cerrada hexagonal distorsionada con una distancia alargada entre capas empaquetadas cerradas.
La densidad de Cd es ligeramente inferior a la del cobre y la plata. Es un metal más suave y de bajo punto de fusión en comparación con otros metales de transición.
| Cadmio | |||
| Símbolo | CD | ||
| Descubrimiento | Friedrich Stromeyer en 1817 | ||
| Nombre derivado de | La palabra latina cadmia se deriva del nombre mineral calamina | ||
| isótopo común | 48CD114 | ||
| Estados de oxidación | 2 | ||
| número CAS | 7440-43-9 | ||
| Propiedades periódicas | |||
| número atómico | 48 | ||
| Masa atómica relativa | 112,414 | ||
| electrón por celda | 2, 8, 18, 18, 2 | ||
| Configuración electrónica | [Kr] 4d10 5s2 | ||
| Bloquear | bloque d | ||
| Grupo | 12 | ||
| Período de tiempo | 5 | ||
| Características físicas | |||
| Condición a 20 °C | firma | ||
| Punto de fusion | 321.069°C, 594.219K | ||
| Punto de ebullición | 767°C, 1040K | ||
| Capacidad calorífica molar | 26.020 J mol−1 k1 | ||
| estructura cristalina | empaquetado herméticamente hexagonal (hcp) | ||
| Espesor | 8,69 g/cm23 | ||
| Resistencia eléctrica | 72,7nm | ||
| Propiedades atómicas | |||
| Radio atómico (sin consolidar) | 2.18 | ||
| Radio covalente | 1.40 | ||
| Electronegatividad | 1,69 (escala de Pauling) | ||
| Afinidad electronica | desconocido | ||
| Energía de ionización (kJ/mol) | 1º | 2do | 3ro |
| 867.78 | 1631.40 | 3616.27 | |
Configuración electronica
Los 48 electrones del átomo de Cd se dividen en diferentes niveles de energía para mostrar la siguiente configuración electrónica debajo de la imagen,
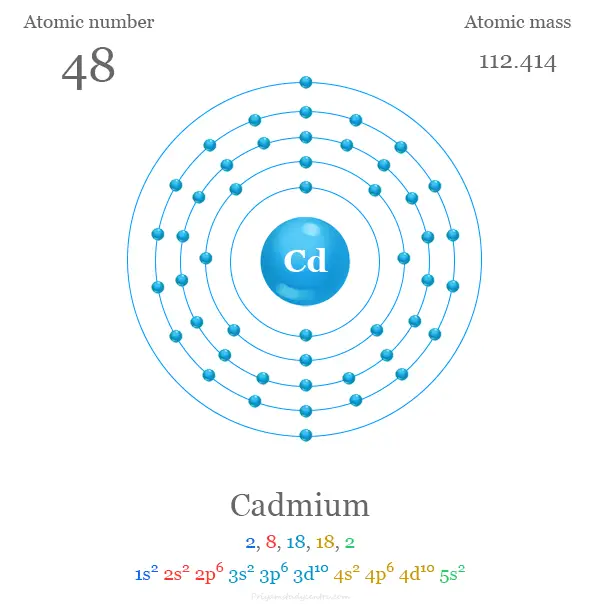
Los metales zinc, cadmio y mercurio contienen ns2 configuraciones electrónicas externas tales como metales alcalinotérreos calcio, estroncio y bario. Pero las energías de ionización primera y segunda de estos elementos del bloque d son significativamente más altas que las del calcio, el estroncio y el bario.
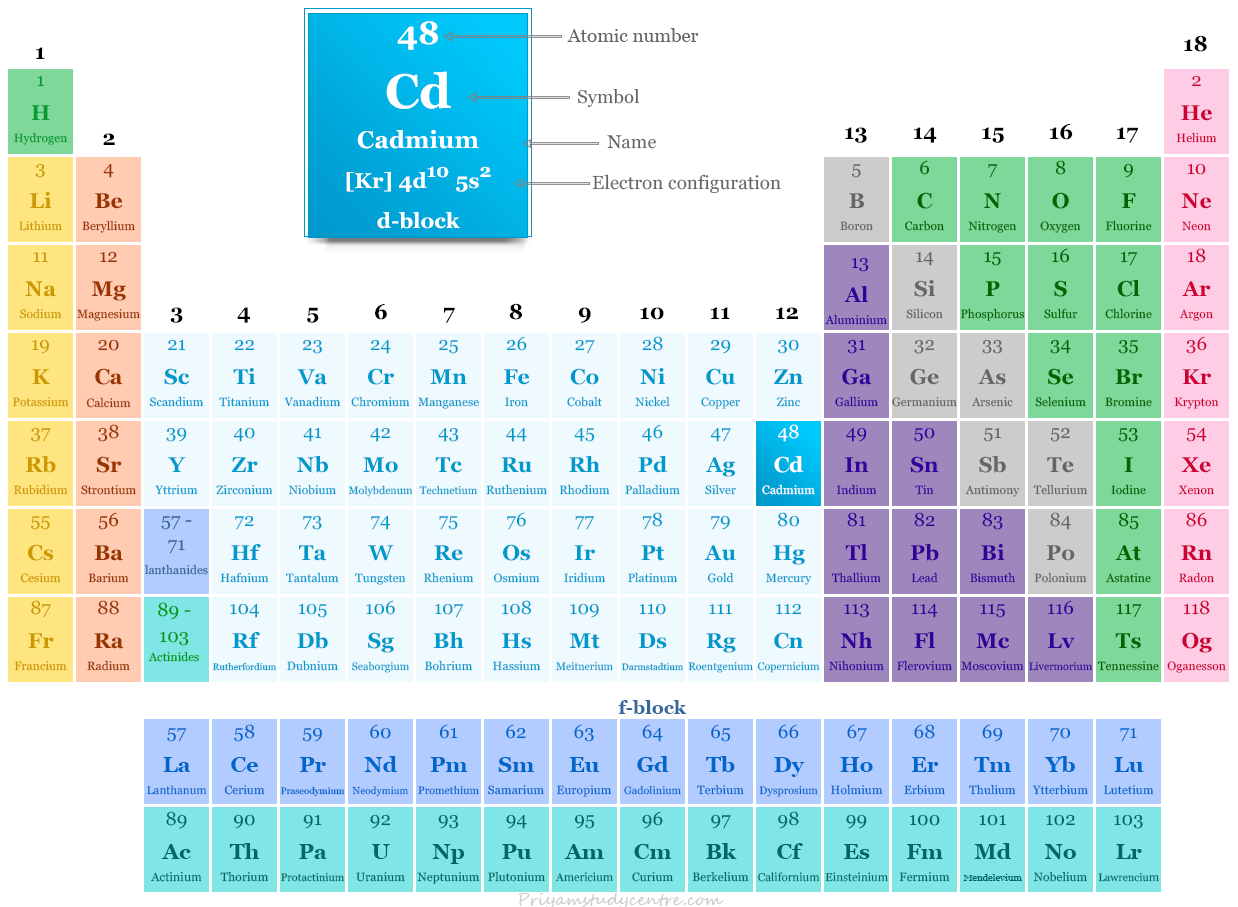
Cadmio en la tabla periódica
El cadmio se coloca en el grupo 12 y el período 5 en la tabla periódica. Es un elemento del bloque d que se encuentra entre la plata y el indio.
Propiedades químicas
El único estado de oxidación estable para Cd es +2. Al igual que el mercurio, también exhibe un estado de oxidación de +1. El óxido, el sulfuro y los haluros son los principales compuestos de cadmio, pero los hidruros, nitruros y haluros son inestables. También se han identificado muchos complejos de cadmio con nucleobases, aminoácidos, vitaminas y enzimas.
Se quema en el aire para formar óxido de cadmio amorfo marrón (CdO). El sólido cristalino rojo oscuro CdO se obtiene al calentar. Adopta una red cristalina tipo cloruro de sodio. El color rojo oscuro también cambia a negro cuando se calienta debido a defectos de rejilla.
El cadmio puede disolverse en ácidos minerales como el ácido clorhídrico, sulfúrico o nítrico liberando hidrógeno y formando CdCl2(CdSO4), o CD (NO3)2.
La adición de hidróxido de sodio o hidróxido de potasio al Cd+2 la solución precipita Cd(OH) blanco2. Se puede disolver en álcali concentrado bajo ebullición prolongada para formar hidroxocadmiatos, K4[Cd(OH)6].
La principal diferencia entre la primera y la segunda energía de ionización para Cd sugiere la formación de un Cd+ ion. En la práctica, el estado univalente, al igual que el estado de mercurio (I), se presenta en forma de Cd2+2. Es fácilmente desproporcionado en una solución acuosa a Cd y Cd. Dar forma+2 iones
CD2+2 → CD↓ + CD+2
El sulfuro de Cd es bien conocido por nosotros en el análisis de grupo de rutina de Cd+2. CdS precipitado por sulfuro de hidrógeno de un medio de HCl diluido porque CdS requiere un medio débilmente ácido para la precipitación completa.
Datos sobre el cadmio
- El cadmio blanco blando, maleable, maleable y plateado es insoluble en agua.
- La forma de metal a granel no es inflamable, pero la forma de polvo puede arder y liberar gases tóxicos.
- El cadmio se produce principalmente en combinación con el zinc, pero se recupera como subproducto durante la refinación del zinc, el plomo y el cobre.
- Naturalmente, una gran cantidad de Cd se libera en nuestro medio ambiente debido a la erosión de las rocas, los incendios forestales y los volcanes. Una cantidad significativa de Cd también es liberada por diversas actividades humanas.
- Los elementos Zn, Cd y Hg pertenecen al bloque d, pero no están incluidos en la serie de elementos de transición porque no forman compuestos en los que la capa d esté parcialmente ocupada.
- Sin embargo, los elementos (Zn, Cd y Hg) se asemejan a los metales de transición cuando forman compuestos complejos con una variedad de ligandos como el amoníaco., aminas, iones de haluro y cianuro. Pero no se conocen los complejos con otros ligandos aceptores fuertes.
- La mayor parte del cadmio producido hoy en día a partir de subproductos de zinc se utiliza para fabricar baterías de níquel-cadmio.
- Los láseres de helio-cadmio son una fuente común de luz láser azul o ultravioleta con longitudes de onda de 325, 354 y 442 nm. Estos láseres se utilizan en microscopía de fluorescencia y en varios equipos de laboratorio que requieren luz láser en estas longitudes de onda.
Uso de cadmio
El uso de cadmio ha disminuido en los últimos años debido a su comportamiento tóxico. Provoca defectos de nacimiento y cáncer. Se utiliza principalmente para fabricar baterías, aleaciones, revestimientos (galvanización), células solares, estabilizadores de plástico y pigmentos.
- La mayor parte del cadmio que se produce en la actualidad se utiliza para la producción de baterías recargables fabricadas con celdas de níquel-cadmio. Estas baterías han sido reemplazadas hoy por baterías de hidruro metálico de níquel y de iones de litio debido a la toxicidad del Cd.
- Se utiliza principalmente en el revestimiento de acero con cadmio para evitar la corrosión. Estas aleaciones de Cd todavía se utilizan para proteger partes críticas de aeronaves y plataformas petroleras.
- Es una parte de algunos materiales semiconductores.
- El sulfuro de cadmio, el seleniuro o el telururo se utilizan en algunos fotodetectores y células solares para producir energía solar.
- Los complejos de metales pesados ofrecen grandes beneficios para el tratamiento del cáncer, pero su uso suele estar limitado debido a los efectos secundarios tóxicos del cadmio.
- Históricamente, los compuestos de cadmio se pueden usar como fósforos en televisores en blanco y negro, televisores en color y pigmentos amarillos, naranjas y rojos.
- Los compuestos de cadmio se utilizan para estabilizar el PVC frente a la degradación por el calor y la radiación ultravioleta-visible. Actualmente, los estabilizadores de Cd han sido completamente reemplazados por estabilizadores de bario-zinc, calcio-zinc y organoestaño.
- Las barras de cadmio se utilizan en reactores nucleares como absorbentes de neutrones para controlar la fisión nuclear.
- La amalgama de cadmio se utiliza en laboratorios para reducir compuestos orgánicos.
Toxicidad por cadmio
El cadmio ingresa al agua a través de descargas industriales o el deterioro de las tuberías galvanizadas. Es tóxico para ciertos peces en concentraciones superiores a 200 ppb, mientras que el nivel normal de Cd en agua potable es de 0,4 a 60 ppb.
También se puede concentrar en plantas donde entran con zinc. La pequeña cantidad de cadmio que ingresa al cuerpo humano se excreta a través de los riñones, pero la fracción residual se une a las proteínas del cuerpo. Eventualmente conduce a la desinfección del riñón.
Una dosis diaria demasiado alta o la inhalación puede causar los siguientes problemas de salud:
- Diarrea, dolor de estómago y vómitos
- falla reproductiva
- fractura de hueso
- Daño al sistema inmunológico y al sistema nervioso central
- Desordenes mentales
- Daño en el ADN o desarrollo de cáncer.
El cadmio puede reemplazar al zinc en nuestro cuerpo e inhibir la acción de las enzimas de zinc.












