
Elemento de rutenio
rutenio es un elemento químico o metal del grupo 8 en la tabla periódica con el símbolo tu y número atómico 44. Es un metal blanco duro que pertenece al grupo de los metales del platino (PGM). metal rutenio es el metal de transición más raro de la Tierra que imparte dureza al platino y al paladio.

La demanda y el precio del rutenio están aumentando debido al uso generalizado del metal en las industrias electrónica y química. En estas dos industrias se utiliza principalmente para la fabricación de contactos eléctricos y ánodos para la producción de cloro en celdas electroquímicas. También se utiliza en la tecnología solar para la producción de energía eléctrica a partir de la energía solar.
Lectura relacionada: Iterbio - Elemento, Uso, Hechos
Iterbio - Elemento, Uso, HechosEl rutenio fue descubierto en 1844 por el científico ruso de ascendencia báltico-alemana Karl Ernst Claus. El nombre del metal se le dio en honor al país de Rusia.
¿Dónde se encuentra el rutenio?
El rutenio es uno de los metales más raros de la Tierra, generalmente se encuentra en minerales de otros metales de platino en los Montes Urales y en las Américas. La fuente principal del metal se encuentra en Sudáfrica, Canadá, Rusia, Brasil, Colombia, etc.
Es el 78º elemento más abundante en la corteza terrestre que se encuentra en la naturaleza en su forma no combinada. Comercialmente, se puede recuperar a partir de residuos de refinación de níquel.
Lectura relacionada: Erbio - Elemento, Símbolo, Uso, Hechos
Erbio - Elemento, Símbolo, Uso, HechosLa abundancia de metales de platino en la corteza terrestre es de 0,01 ppm o menos. El rutenio es relativamente raro en la Tierra y se encuentra en aproximadamente 100 partes por billón. Muy a menudo, el elemento se encuentra en los minerales pentlandita y piroxinita.
isótopos
El rutenio metálico tiene siete isótopos estables naturales. También tiene 27 isótopos radiactivos producidos por diversas reacciones nucleares artificiales. De estos 27 isótopos radiactivos, los más estables son: 106ru, 103ru, y 97ru. La vida media de la mayoría de estos isótopos radiactivos es de menos de cinco minutos.
El principal modo de desintegración radiactiva de estos isótopos es la captura de electrones y la emisión beta. El principal producto de descomposición de los radioisótopos es el tecnecio y el rodio.
Lectura relacionada: Itrio - Elemento, Símbolo, Hechos, Uso
Itrio - Elemento, Símbolo, Hechos, UsoLa concentración de rutenio es relativamente alta durante la fisión de los reactores nucleares. Por lo tanto, la mayor parte del Ru-106 de vida larga también se puede recuperar de los desechos radiactivos. El isótopo Ru-106 se encuentra en la fisión nuclear de uranio o plutonio.
Proceso de producción
Cada año se extraen unas 30 toneladas de rutenio en el mundo. La composición de los metales del grupo del platino extraídos varía mucho según la geolocalización. Por ejemplo, los metales del grupo del platino extraídos en Sudáfrica contienen en promedio un 11 % de rutenio, mientras que los metales del grupo del platino extraídos en la antigua URSS contienen solo un 2 %.
El rutenio se obtiene comercialmente como subproducto de la refinación de los metales níquel, cobre y platino. Durante la electrorrefinación del cobre y el níquel, los metales preciosos como la plata, el oro y los metales del grupo del platino se precipitan como lodos anódicos.
Refinación de rutenio
La refinación de rutenio y otros metales de platino del lodo del ánodo se indica a continuación.
- El tratamiento del lodo del ánodo con agua regia elimina el platino, el paladio y el oro. Puede contener sales solubles de PtCl. Dar forma6−2PdCl4−2y AuCl4−2.
- El residuo de cloruros insolubles de osmio, rutenio, rodio, iridio y plata se fusiona con carbonato de plomo seguido de tratamiento con ácido nítrico. La plata se introduce en la solución como nitrato de plata.
- Después de la eliminación de la plata, el residuo insoluble se fusiona con NaHSO4 y lixiviado con agua. El rodio se disuelve como Rh2(ASI QUE4)3.
- El residuo insoluble después de la separación del rodio se fusiona con peróxido de sodio y se lixivia con agua. Ru y Os pasan a la solución como RuO4−2 y [OsO4(OH)2]−2 pero el iridio permanece como un residuo de IrO2.
- Se introduce cloro en la solución que contiene rutenio y osmio. Al calentar la solución, OsO4 evaporado y separado.
- Después de eliminar el osmio, la solución contiene H3RuCl6. de los cuales (NH4)3RuCl6 es precipitado por NH4clase El precipitado se calienta con hidrógeno para dar rutenio metálico.
Propiedades
El rutenio es un metal de transición duro, quebradizo, de color blanco plateado que normalmente no reacciona con ácidos, agua o aire. Pertenece a la familia de los metales preciosos o metales del platino en la tabla periódica.
| rutenio | |||
| Símbolo | tu | ||
| Descubrimiento | Karl Karlovich Klaus en 1844 | ||
| Nombre derivado de | La palabra Ruthenia que tiene el nombre latino de Rusia | ||
| isótopos comunes | 44tu101, 44tu102, 44tu104 | ||
| Estados de oxidación | +8, +6, +4+3, +2, 0, −2 | ||
| número CAS | 7440-18-8 | ||
| Propiedades periódicas | |||
| número atómico | 44 | ||
| Masa atómica relativa | 101.07 | ||
| electrón por celda | 2, 8, 18, 15, 1 | ||
| Configuración electrónica | [Kr] 4d7 5s1 | ||
| Bloquear | bloque d | ||
| Grupo | 8 | ||
| Período de tiempo | 5 | ||
| Características físicas | |||
| Condición a 20 °C | firma | ||
| Punto de fusion | 2333°C, 2606K | ||
| Punto de ebullición | 4147°C, 4420K | ||
| Capacidad calorífica molar | 24,06 J mol−1 k1 | ||
| estructura cristalina | empaquetado hexagonal (hcp) | ||
| Espesor | 12,1 g/cm23 | ||
| Resistencia eléctrica | 71nm | ||
| Propiedades atómicas | |||
| Radio atómico (sin consolidar) | 2.13 | ||
| Radio covalente | 1.36 | ||
| Electronegatividad | 2.2 (escala de Pauling) | ||
| Afinidad electronica | 101,31 kJ mol−1 | ||
| Energía de ionización (kJ/mol) | 1º | 2do | 3ro |
| 710.18 | 1617.09 | 2746.94 | |
Configuración electronica
Los 44 electrones en el átomo de rutenio se dividen en diferentes niveles de energía para mostrar la siguiente configuración electrónica debajo de la imagen,
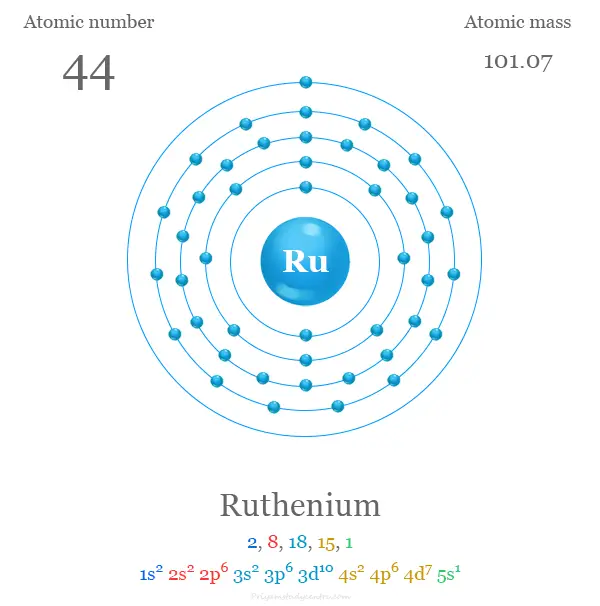
Rutenio en la tabla periódica
El rutenio se coloca en el grupo 8 y el período 5 en la tabla periódica. Es un elemento del bloque d o metal de transición que se encuentra entre el tecnecio y el rodio.
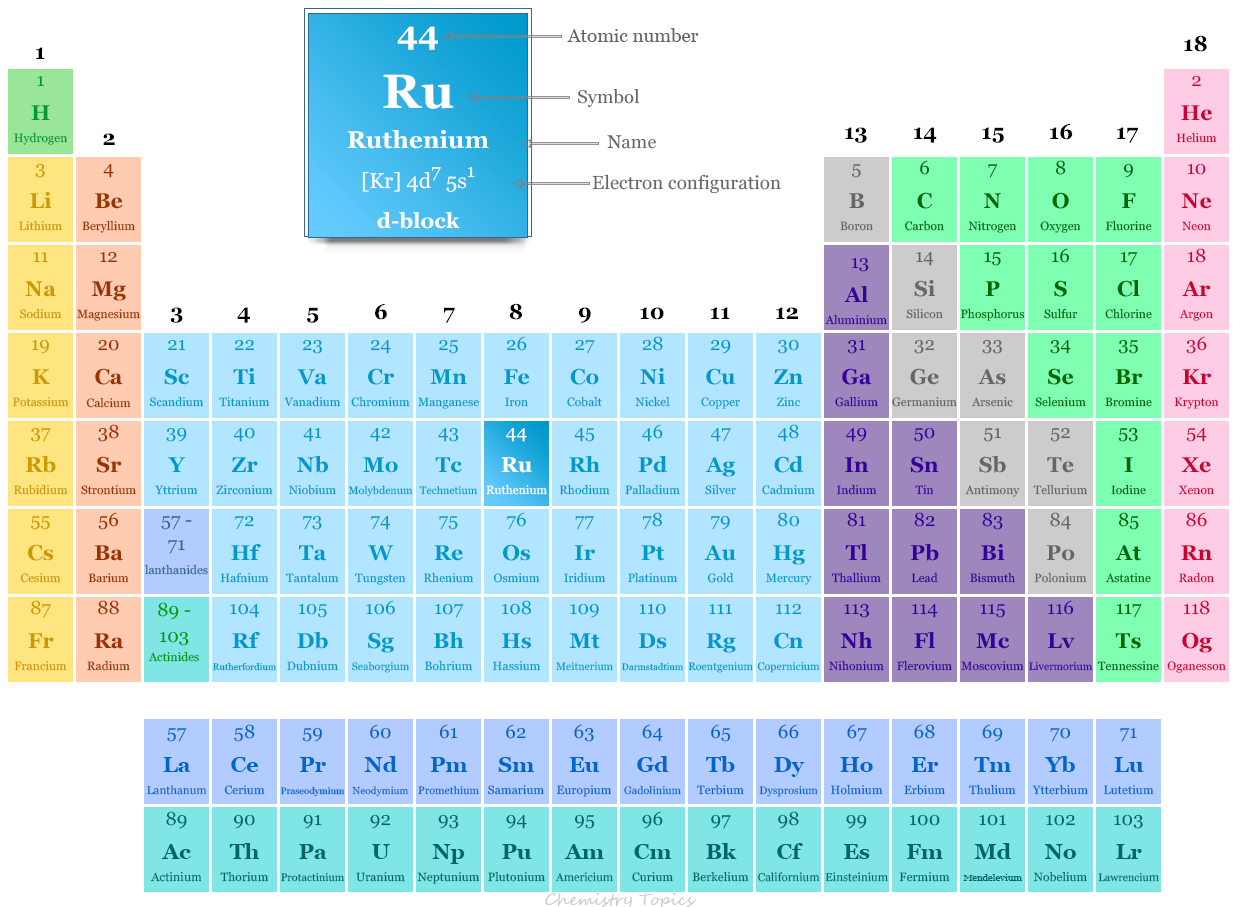
Ingredientes químicos
El platino o rutenio, un metal precioso, es bastante poco reactivo. El metal exhibe el estado de oxidación VIII más alto observado, pero los estados VI y IV del metal también son muy estables.
Forma una amplia variedad de compuestos químicos en diferentes estados de oxidación. Los óxidos, fluoruros y complejos de rutenio más comunes en los estados de oxidación +4 y +6 se detallan a continuación,
Óxidos de rutenio
Los estados de oxidación IV y VI de Ru son bastante estables. Se quema directamente en el aire para formar dióxido de rutenio azul-negro con la fórmula química RuO2. El dióxido es un sólido estable con estructura de rutilo e insoluble en agua.
El tetróxido de rutenio amarillo anaranjado volátil (RuO4) se forma por oxidación de Ru(VI) en una solución ácida con KBrO3KMnO4cl2, etc. La molécula contiene una estructura tetraédrica regular con un olor a ozono. Es un agente oxidante fuerte que se disuelve en álcali al desarrollar oxígeno gaseoso.
Fluoruros de rutenio
La forma de hexafluoruro y tetrafluoruro de rutenio es común. El hexafluoruro de color marrón (RuF6) se obtiene haciendo reaccionar Ru con flúor bajo presión y extinguiendo el vapor.
Formó RuF amarillo4 cuando RuF5 se reduce con yodo. RuF5 es un producto normal de la reacción entre el Ru y el flúor. Presumiblemente, el compuesto de tetrafluoruro es de naturaleza polimérica.
Complejos de coordinación
En estados de oxidación más bajos, el metal forma una variedad de complejos de coordinación. Se han observado algunos compuestos simples en el estado +2 del metal. Formó numerosos complejos con amina y arsina. Estos complejos se forman por la reducción de rutenio metálico en presencia de ligandos.
Reducción de RuCl3 con hidrazina o amalgama de zinc en presencia de amoníaco da complejo de dinitrógeno [Ru(NH3)5N2]+. Se informa que es el primer compuesto que contiene una molécula de nitrógeno coordinada.
Datos sobre el rutenio
- El rutenio fue el último grupo de metales del platino descubierto en 1844 por el científico nacido en Rusia de ascendencia báltico-alemana Karl Ernst Claus.
- El nombre del elemento proviene de la palabra latina Ruthenia que significa Rusia. Se refiere a los Montes Urales de Rusia, la fuente original de minerales de metales de platino.
- Es el único elemento del grupo 8 que no contiene 2 electrones en su capa cuántica externa.
- Muestra una amplia gama de números de oxidación o estados. Los estados de oxidación más comunes del metal son +8, +6 y +4.
- Al igual que otros metales de platino, forma una amplia variedad de compuestos binarios como óxidos, sulfuros y especialmente haluros.
- Es un catalizador versátil utilizado en la eliminación de sulfuro de hidrógeno de las refinerías de petróleo y otros procesos industriales. El catalizador de rutenio también se utiliza para la producción de amoníaco y ácido acético.
- Es tóxico para las personas que piensan que tiene propiedades cancerígenas. Tetróxido de rutenio (RuO4) es particularmente peligroso para los humanos.
Uso de rutenio
- El rutenio es un importante agente de aleación para impartir dureza al platino y al paladio.
- También se utiliza como catalizador químico para la producción de amoniaco a partir de gas natural y ácido acético a partir de metanol.
- El rutenio se utiliza en la industria electrónica para fabricar resistencias y contactos eléctricos.
- En el proceso de producción de cloro, el óxido de rutenio se usa para recubrir los ánodos de las celdas electroquímicas.
- Se agrega a las aleaciones de titanio para mejorar las propiedades de resistencia a la corrosión de las aleaciones de titanio.
- También se utiliza para aleaciones de cobalto, molibdeno, níquel, tungsteno y otros metales.
- Los compuestos de rutenio se pueden utilizar en células solares para producir energía solar renovable.
- Está aleado con platino para la producción de algunas joyas.
- El isótopo degradante beta rutenio 106 se usa en radioterapia para tratar tumores oculares y melanoma maligno de la úvea.
Precio del rutenio
Es muy utilizado en la industria eléctrica porque las propiedades del rutenio son similares a las del rodio, pero el precio del Ru es inferior al del rodio.
La placa de rutenio se utiliza en electrólisis electrolítica de contacto y basada en electrodos o pulverización catódica. El precio promedio del metal rutenio puro es de alrededor de $ 1400 por 100 gramos.












