¿Qué es el sodio?
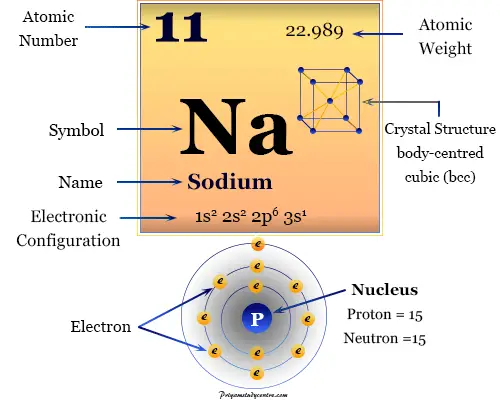
Sodio es un metal alcalino blanco plateado, de bajo punto de fusión, blando o elemento químico del grupo 1 o IA de la tabla periódica con el símbolo Na y el número atómico 11. Está ampliamente involucrado en nuestro proceso de vida y muchos de sus compuestos se utilizan desde los primeros días de la civilización humana. Fue aislado por primera vez por Humphry Davy en 1807 mediante la electrólisis del hidróxido de sodio (NaOH).
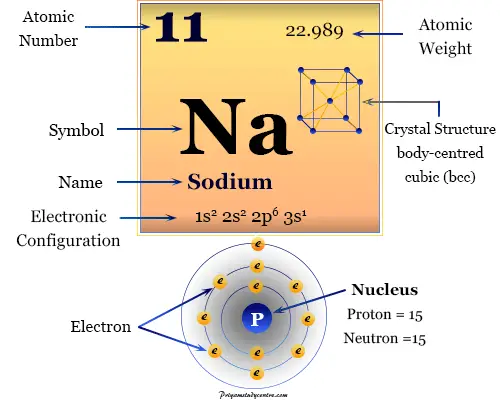
La configuración electrónica del metal alcalino sodio es 1s2 2s2 2p6 3s1. Debido a la presencia de 3s1 configuración electrónica externa, el sodio de metal alcalino ocupa el Grupo-1 o 1A en la tabla periódica.
Lectura relacionada: Berilio, Símbolo, Propiedades, Hechos, Conexiones, Uso
Berilio, Símbolo, Propiedades, Hechos, Conexiones, UsoPropiedades del sodio
Las propiedades físicas y químicas del elemento se entienden fácilmente en términos de su configuración electrónica externa simple. Algunas propiedades físicas y químicas, como el punto de fusión, el punto de ebullición, el número o estado general de oxidación y la densidad, se dan debajo de la tabla.
| Propiedades del sodio | |||
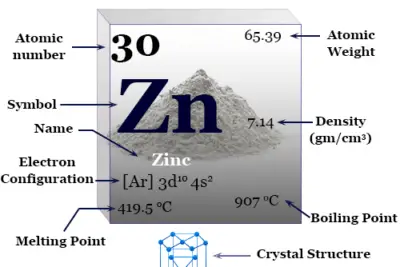
| Nombre | Sodio | ||
| Símbolo | na | ||
| Nombre derivado de | La palabra inglesa 'soda' | ||
| número atómico | 11 | ||
| Descubrimiento | Humphry Davy en 1807 | ||
| electrón por escala | 2-8-1 | ||
| Configuración electrónica | 1s2 2s2 2p6 3s1 | ||
| Grupo | grupo 1 | ||
| Período de tiempo | periodo-3 | ||
| número CAS | 7440-23-5 | ||
| Peso atomico | 22.989 | ||
| Se mantiene a 20°C | firma | ||
| Punto de fusion | 97,79 °C, 208,03 °F | ||
| Punto de ebullición | 882,94 °C, 1621,29 °F | ||
| isótopo común | 23no | ||
| Espesor | 0,968 g/cm3 | ||
| Capacidad calorífica molar | 28,230 J mol−1 k−1 | ||
| Resistencia eléctrica | 47,7 nΩ·m | ||
| Radio atómico | 186 horas | ||
| Radio covalente | 166 ± 21 horas | ||
| Propiedades químicas | |||
| número de oxidación | +1 | ||
| Electronegatividad | Escala de Pauling: 0,93 | ||
| Energía de ionización (kJ/mol) | 1º | 2do | 3ro |
| 495.8 | 4562 | 6910 | |
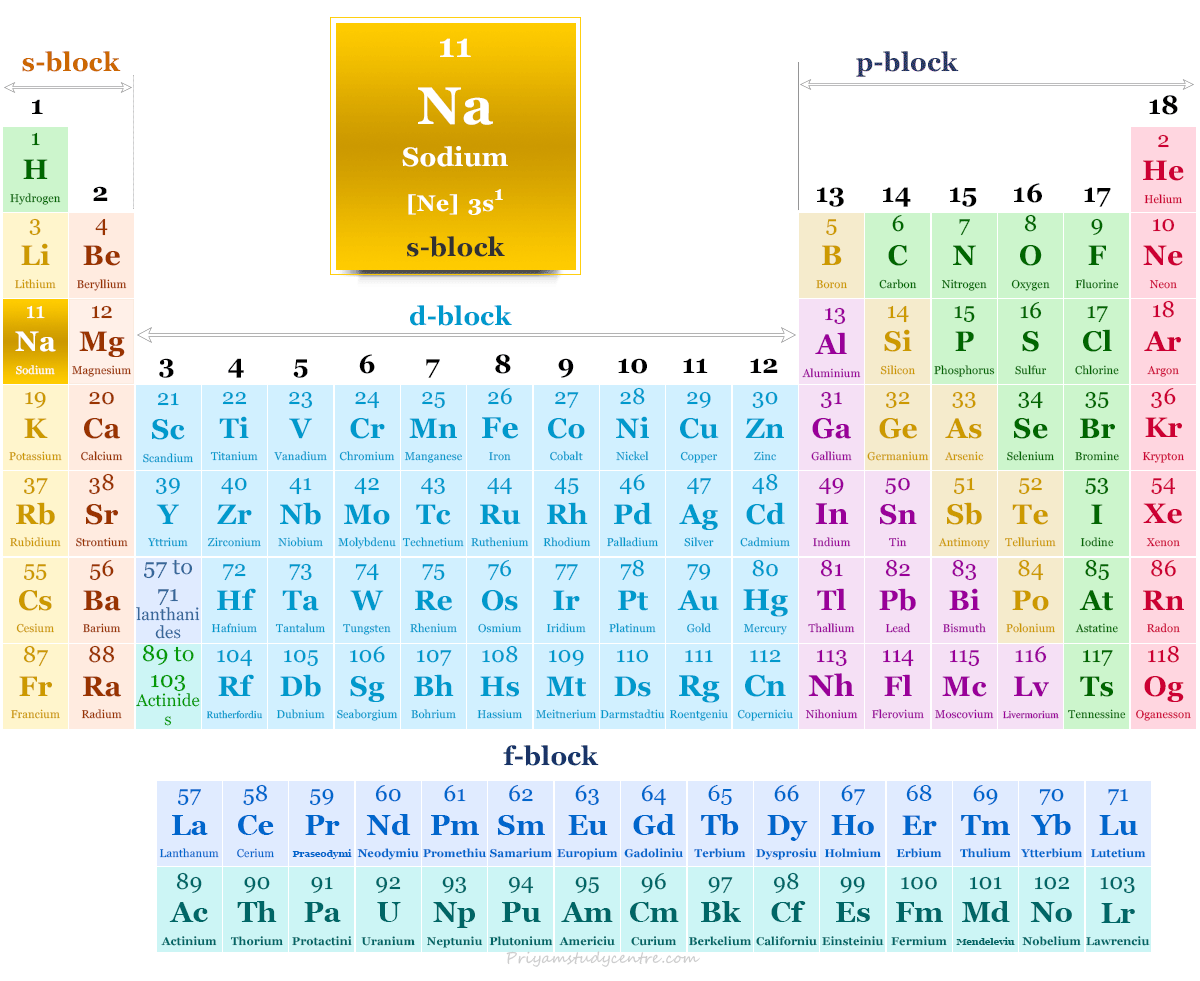
Posición del sodio en la tabla periódica
 Niquel, Símbolo, Propiedades, Producción, Hechos, Uso
Niquel, Símbolo, Propiedades, Producción, Hechos, Uso¿Dónde se encuentra el sodio?
El sodio es el séptimo elemento más abundante de la tabla periódica y el quinto metal más abundante después del aluminio, el hierro, el calcio y el magnesio. Ha encontrado 22.700 ppm en la corteza terrestre. Se encuentra en muchos minerales como la sal gema (NaCl), el carbonato (trona), el nitrato (salitre), el borato (bórax), etc.
El enorme depósito de sal de roca se puede obtener de la evaporación de mares antiguos. El campo de sal de Cheshire en el Reino Unido cubre áreas de (60 km x 24 km) y una capa de casi 400 metros de espesor. Depósitos similares se encuentran en Saskatchewan, Canadá y Carlsbad, Nuevo México. Además de las sales de roca, la salmuera natural y el agua de mar contienen grandes cantidades de cloruro de sodio.
Sodio en organismos vivos
Los organismos vegetales y animales contienen compuestos de sodio, principalmente NaCl. no+ El ion constituye alrededor del 0,3 por ciento de la sangre humana, el 0,6 por ciento de los huesos y del 0,6 al 1,5 por ciento de los músculos del cuerpo.
Lectura relacionada: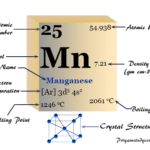 manganeso, Símbolo, Propiedades, Conexiones, Uso
manganeso, Símbolo, Propiedades, Conexiones, UsoProceso de producción
El sodio se produce por electrólisis de una mezcla fundida de NaCl y CaCl.2. La temperatura de electrólisis es significativamente más baja que el punto de fusión del cloruro de sodio puro (803 °C). Por lo tanto, las dificultades de la volatilidad del Na (punto de ebullición 883 °C) se han eliminado en gran medida.
En tales condiciones, el potencial de descarga del Na+ ion es más bajo que el del Ca+2 ion. Se deposita preferentemente con 1 a 2 por ciento de calcio metal en un cátodo de acero cilíndrico. El cloro liberado en este proceso de producción en el electrodo de grafito central (ánodo) se recolecta a través del domo de níquel.
Datos sobre el sodio
- Todos los metales alcalinos como el litio, el sodio, el potasio y el rubidio son metales blandos, de bajo punto de fusión, de color blanco plateado, pero el cesio tiene un color amarillo dorado.
- Normalmente adoptan una estructura cristalina cúbica centrada en el cuerpo, pero a baja temperatura, el litio forma un paquete cerrado hexagonal.
- Solo un electrón en el orbital 3s del átomo metálico participa en el enlace químico metálico. Hace que el metal sea suave y materiales de bajo punto de fusión.
- La gran diferencia entre la primera y la segunda energía de ionización del sodio sugiere que el estado de oxidación preferido del metal será +1.
Ingredientes químicos
La energía de ionización inicial del metal es más que la energía de red compensada, lo que sugiere que la mayoría de los compuestos se forman por enlace iónico. Por lo tanto, la química principal del elemento está dominada por enlaces iónicos. La reactividad de los metales alcalinos hacia el agua aumenta de litio a cesio.
A 25°C, el agua reacciona lentamente con el litio, el sodio reacciona violentamente, el potasio reacciona con la llama y el rubidio y el cesio reaccionan con la explosión. Se quema con aire u oxígeno para obtener Na. dar2O2. El sodio reacciona con el carbono para formar acetiluros Na2C2. Forma una serie de sales sólidas cristalinas con diferentes tipos de aniones que son solubles en agua.
hidruro de sodio
Reacciona directamente con el hidrógeno cuando se calienta para formar un hidruro iónico que contiene H. contiene ion. Todos los haluros de metales alcalinos son sólidos cristalinos solubles en agua e incoloros formados por la reacción de MOH o M2CO3 con el HX correcto.
uso de sodio
- Más de la mitad del sodio producido anualmente se utiliza para producir una aleación de Na/Pb en la producción de tetraetilo de plomo (un agente antidetonante). Es probable que la producción y la producción de tetraetilo de plomo disminuyan debido a la contaminación ambiental o la formación de plomo.
- Se utiliza como agente reductor en la extracción de titanio y circonio.
- Una cantidad significativa de metal se consume en la producción de varios tipos de compuestos de sodio como hidróxido (NaOH), peróxido (Na2O2), hidruro (NaH), compuestos orgánicos de sodio, etc.
- La dispersión de sodio en diversos medios, como el carbono y el carbonato de potasio, se utiliza como catalizador químico en diversas reacciones de alquenos. Estos se utilizan para la producción de caucho sintético.
- El metal tiene un bajo punto de fusión, baja viscosidad y baja sección transversal de absorción de neutrones con alta capacidad calorífica y conductividad térmica. Por lo tanto, el sodio es el material más favorable para el intercambio de calor en el reactor nuclear reproductor rápido.
NaCl usado
- Los usos del cloruro de sodio en la industria son simplemente numerosos. Es el material de partida para la producción de NaOH, Na2CO3no2ASI QUE4etc.
- Alrededor del 50 por ciento de NaCl se usa para producir NaOH y alrededor del 10 por ciento se usa para hacer Na2CO3.
- Es muy utilizado en la conservación de alimentos.
- En ciertas provincias invernales, se utilizan grandes cantidades de NaCl para limpiar la nieve de las carreteras.
- Las curtidurías de papel, caucho, ablandamiento de agua y cuero son las principales consumidoras de NaCl.
Uso de NaOH
- El hidróxido de sodio se utiliza en gran medida en la fabricación de diversos tipos de productos químicos, como alcohol o fenol, resorcinol, hipoclorito, fosfato, etc.
- Se utiliza una gran cantidad de NaOH en las industrias del papel, la pulpa y el rayón. También se utiliza para la extracción de aluminio.
Uso de ceniza de soda
- Se utiliza mucho en la industria del vidrio, la industria del papel, en piscinas para el mantenimiento de la escala de pH.
- El carbonato de sodio también se usa para producir productos para el cuidado personal como detergentes, jabones y pasta de dientes.