
El Circonio o Zirconio es un elemento químico o metal de transición blanco plateado, duro y de alto punto de fusión del grupo 4 (IVB) de la tabla periódica con el símbolo Zr y número atómico 40. Se coloca en elementos del bloque d con miembros del grupo titanio y hafnio. Se utiliza para fabricar acero a prueba de balas y otras aleaciones resistentes a la corrosión.

Propiedades del circonio
El metal es bastante electropositivo de dióxido cuando se calienta. El metal sólido a temperatura ambiente es resistente a la corrosión.
Lectura relacionada: Metales de transición: elementos, definición, lista, propiedades
Metales de transición: elementos, definición, lista, propiedadesSólo se disuelve en ácido sulfúrico concentrado caliente, agua regia y ácido fluorhídrico. El álcali acuoso caliente no ataca este metal de transición. Algunas propiedades comunes del circonio se dan debajo de la tabla,
| Propiedades del circonio |
|||
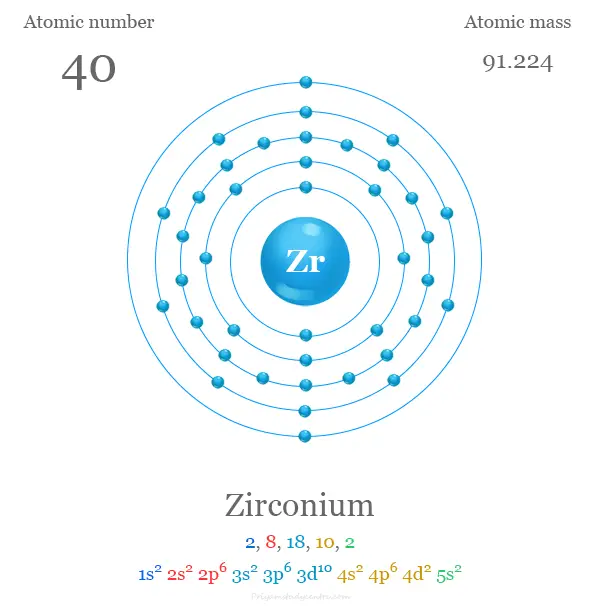
| número atómico | 40 | ||
| electrón por escala | 2, 8, 18, 10, 2 | ||
| Configuración electrónica | [Kr] 4d2 5s2 | ||
| Bloquear | bloque d | ||
| Período de tiempo | periodo 5 | ||
| Grupo | grupo 4 | ||
| Peso atomico | 91,224 | ||
| Punto de fusion | 2128K (1855°C, 3371°F) | ||
| Punto de ebullición | 4650K (4377°C, 7911°F) | ||
| estructura cristalina | empaquetado hexagonal (hcp) | ||
| Espesor | 6,52 g/cm3 | ||
| Capacidad calorífica molar | 25,36 J mol−1k−1 | ||
| Resistencia eléctrica | 421 nΩ·m | ||
| Radio atómico | 160 horas | ||
| Radio covalente | 175 ± 19 horas | ||
| Propiedades químicas | |||
| Número de oxidación común | +4 | ||
| Electronegatividad | Escala de Pauling: 1,33" | ||
| Energía de ionización (kJ/mol) | 1º | 2do | 3ro |
| 640.1 | 1270 | 2218 | |
Configuración electrónica del circonio
Los 40 electrones del átomo de plata se dividen en diferentes niveles de energía para mostrar la siguiente configuración electrónica debajo de la imagen,
 Elementos de tierras raras: metales, definición, propiedades, usos
Elementos de tierras raras: metales, definición, propiedades, usosUso de circonio
- El circonio es un absorbente muy bajo de neutrones térmicos, pero puede estar libre de pequeñas cantidades de hafnio que absorbió 600 veces más neutrones. Por lo tanto, es el material ideal para las centrales nucleares. La producción anual de circonio libre de hafnio de grado nuclear siempre ha sido alta, alrededor de 165 toneladas.
- Se utiliza para fabricar tubos de refrigerante sin soldadura para ocho reactores de agua pesada.
- El circonio se utiliza para fabricar acero aleado a prueba de balas y otras aleaciones resistentes a la corrosión.
- En muchas plantas químicas y de acero inoxidable se prefiere al titanio. Las aleaciones de Zr-Sn se utilizan en el enfriador de los reactores nucleares.
- Debido a las propiedades anticorrosivas de los ácidos y álcalis, es ampliamente utilizado en la industria química.
- Al igual que el titanio, se usa en bombas, válvulas, intercambiadores de calor, tuberías, etc. Con el niobio, se usa para fabricar imanes superconductores.
- Se utiliza como depurador en la industria del acero que elimina el oxígeno y el nitrógeno disueltos.
- Para la producción de pigmentos azules y amarillos, el mineral circonio se mezcla con vanadio y praseodimio.
- El óxido de circonio (IV) se utiliza en la fabricación de crisoles refractarios, revestimientos de hornos, piedras de fundición, abrasivos, industrias de vidrio y cerámica.
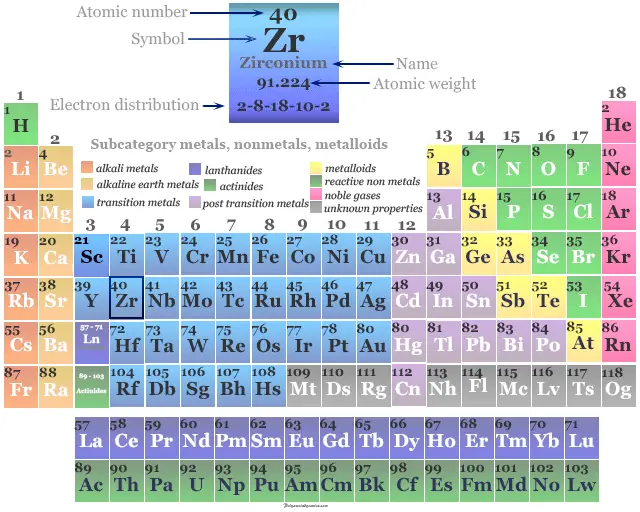
Zirconio en la tabla periódica
Se coloca en el período 5 y el grupo 4 en la tabla periódica. El circonio es un metal de transición o elemento de bloque d que se encuentra entre el itrio y el niobio.
 Calcio, Símbolo, Propiedades, Hechos, Uso, Función
Calcio, Símbolo, Propiedades, Hechos, Uso, Función¿Dónde se encuentra el circonio?
Es una disposición metálica bastante abundante después de los metales de transición hierro, titanio y manganeso. Contiene 0,016 por ciento o 162 ppm de la corteza terrestre.
La principal fuente comercial de circonio es el circonio (ZrSiO4) y baddeleyita (ZrO2). Los minerales se encuentran comúnmente en Australia, Brasil, India, Rusia, Sudáfrica y los Estados Unidos.
Isótopos
Tiene cinco isótopos tales como: 90Zr, 91Zr, 92Zr, 94Zr, y 96Zr. El isótopo radiactivo más longevo del circonio es 96Zr (2,4×1019 años).
Se pueden preparar veintiocho isótopos artificiales del metal, que van desde la masa atómica 78 a 110, mediante varios tipos de reacciones nucleares.
Proceso de producción
Es producido por el proceso de Kroll. Los minerales se convierten en cloruro calentándolos con carbón y cloro. El tetracloruro se reduce con magnesio fundido.
El circonio de alta pureza se produce mediante el proceso van Arkel. El metal se calienta con yodo en un recipiente al vacío a 200°C. El volátil ZrI4 se descompone en un filamento calentado eléctricamente a 1300 ° C. El contenido de hafnio se ha reducido a menos de 100 ppm, lo que se puede lograr mediante extracción con solvente o métodos de intercambio iónico.
Datos interesantes sobre el circonio
El estado de oxidación más común y estable del circonio es +4(IV). Zr+3 es de naturaleza altamente reductora reduciendo la molécula de agua. Por lo tanto, en el estado +3, no tiene química acuosa.
Ingredientes químicos
Circonita
Óxido de circonio (ZrO2) es el óxido sólido más común con un alto punto de fusión. Es insoluble en agua, ácidos diluidos en frío (excepto HF) y álcalis. Reacciona lentamente con ácidos cuando se calienta durante mucho tiempo y con álcali cuando se fusiona.
ZrO2 se utiliza en la fabricación de crisoles refractarios y revestimientos de hornos. El precipitado de hidróxido gelatinoso blanco se obtiene añadiendo álcali a la solución de Zr(IV).
Haluros de circonio
Los cuatro tetrahaluros de circonio son conocidos y se preparan calentando metal con halógenos. Todos los haluros son sólidos blancos. La celda unitaria de ZrF sólido4 incluye coordinación 2:8.
en el ZRF4 unidad, cada átomo de Zr está rodeado por ocho iones de flúor en una configuración antiprisma cuadrada. Los tetrahaluros se hidrolizan vigorosamente a temperatura ambiente y producen oxohaluros que son estables a una mayor hidrólisis.
Complejos de circonio
El nitrato y el sulfato de circonio (IV) son las sales básicas del metal. El compuesto de sulfato está formado por ZrO. resolver2 en ácido sulfúrico concentrado caliente. El nitrato anhidro puede ser preparado por N. responder2O5 en ZrCl4.
El gran Zr+4 El ion muestra altos números de coordinación y formó una variedad de complejos de coordinación. Algunos complejos de coordinación de circonio se dan debajo de la tabla,
| Complejos de Zirconio | |||
| Condición de oxidación | Número de coordinación | Geometría | Ejemplos |
| +4 (VI) | 6 | octaédrico | li2[ZrF6]; [Zr(acac)2Cl2] |
| 7 | bipirámide pentagonal | [ZrF7]-3 | |
| 8 | antiprisma cuadrado | [ZrF8]-4; [Zr(acac)4] | |
| dodecaedro | [Zr(ox)4]-4; [ZrX4(diars)2]; [Zr4(OH)8(H2O)16]+8 | ||
Compuestos organometálicos
Algunos derivados de hidrocarburos inestables como Li[Zr(Me)6] se aíslan de la reacción de LiMe y ZrCl4 a bajas temperaturas.
Zr (bencilo)4 es un catalizador químico estable y homogéneo en el proceso Ziegler-Natta. La ciclopentadina (Cp) forma varios compuestos importantes similares a los del titanio. Estos se utilizan como catalizadores homogéneos para la producción de muchos compuestos orgánicos.
Análisis de metal de circonio
Zirconio precipitado en análisis cuantitativos de rutina de metales del Grupo 3 o del Grupo IIIA. Con la adición de peróxido de hidrógeno (H2O2), un precipitado blanco de peróxido de Zr (ZrO2xH2O) apareció. La alizarina-S da un precipitado rojo con la solución de metal en un medio fuertemente ácido. El color se elimina por la acción del flúor.
El circonio también formó un fosfato muy característico Zr (HPO4)2 incluso de la solución que contiene 10 por ciento de ácido sulfúrico.
¿Quién descubrió el circonio?
El mineral circón tiene dos formas principales, jacinto y argot. Los primeros análisis mostraron que se trataba de los óxidos de silicio, hierro, aluminio y calcio.
En 1789, el químico alemán Klaproth descubrió el nuevo elemento del circón y lo llamó circonio. Pero el metal en bruto fue extraído por primera vez en 1824 por Berzelius. El metal Zr puro se obtuvo en 1925 mediante el proceso van Arkel.












