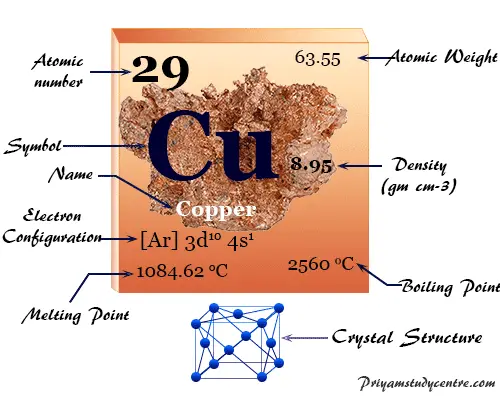
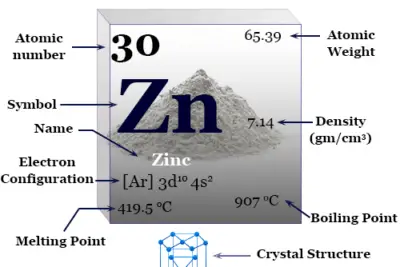
Datos del elemento Cobre
El Cobre es un elemento químico o metal de transición marrón rojizo del grupo 11 o IB de la tabla periódica con el símbolo Cu y número atómico 29. Es un metal blando, resistente y brillante con alta conductividad térmica y eléctrica. El cobre ayuda en la formación de hemoglobina (un transportador de oxígeno) en el cuerpo animal.
El metal forma una red cristalina cúbica centrada en las caras. Se encuentra en nuestro entorno como un estado metálico libre o minerales que se extraen fácilmente.
Lectura relacionada: Fluor, Símbolo, Descubrimiento, Propiedades, Uso, Hechos
Fluor, Símbolo, Descubrimiento, Propiedades, Uso, HechosEl bronce, la aleación de cobre y estaño, ha sido utilizado por la humanidad desde la Edad del Bronce. El cobre se encuentra en la hemocianina en la sangre de calamares y plantas como los guisantes verdes.
¿Quién descubrió el cobre?
El hallazgo arqueológico de la isla, a saber, Chipre en el Mediterráneo oriental, es conocido por sus minas de cobre. El nombre cobre se deriva del nombre latino Cuprum a través de Cyprium.
Propiedades del cobre
En química, las propiedades físicas y químicas de las monedas o de los metales preciosos como Cu, Ag y Au son muy similares.
Lectura relacionada: Nitrogeno, descubrimiento, producción, uso y fijación.
Nitrogeno, descubrimiento, producción, uso y fijación.| Comprador |
|||
| Símbolo químico | Señal | ||
| Descubrimiento | edad histórica | ||
| Nombre derivado de | La antigua palabra inglesa cobre y de la palabra latina Cyprium aes, que significa un metal de Chipre. | ||
| isótopo principal | 29Señal63 | ||
| Estados de oxidación | +1 y +2 | ||
| número CAS | 7440-50-8 | ||
| Propiedades periódicas |
|||
| número atómico | 29 | ||
| Peso atomico | 63.546 | ||
| electrón por escala | 2, 8, 18, 1 | ||
| Configuración electrónica | [Ar] 3d10 4s1 | ||
| Grupo | 11 | ||
| Período de tiempo | 4 | ||
| Bloquear | bloque d | ||
| Características físicas |
|||
| Condición a 20 °C | firma | ||
| punto de encuentro | 1084,6 ºC | ||
| Punto de ebullición | 2560 ºC | ||
| Espesor | 8,95 g/cm23 | ||
| Capacidad calorífica molar | 24.440 J mol−1 k−1 | ||
| estructura cristalina | cúbico centrado en las caras (fcc) | ||
| Resistencia eléctrica | 16,78 nm | ||
| Propiedades atómicas | |||
| Radio atómico (sin consolidar) | 1.96 | ||
| Radio covalente | 1.22 | ||
| Electronegatividad | 1,90 (escala de Pauling) | ||
| Afinidad electronica | 119,16 kJ mol−1 | ||
| Energías de ionización (kJ mol−1) | 1º | 2do | 3ro |
| 745.48 | 1957.92 | 3554.61 | |
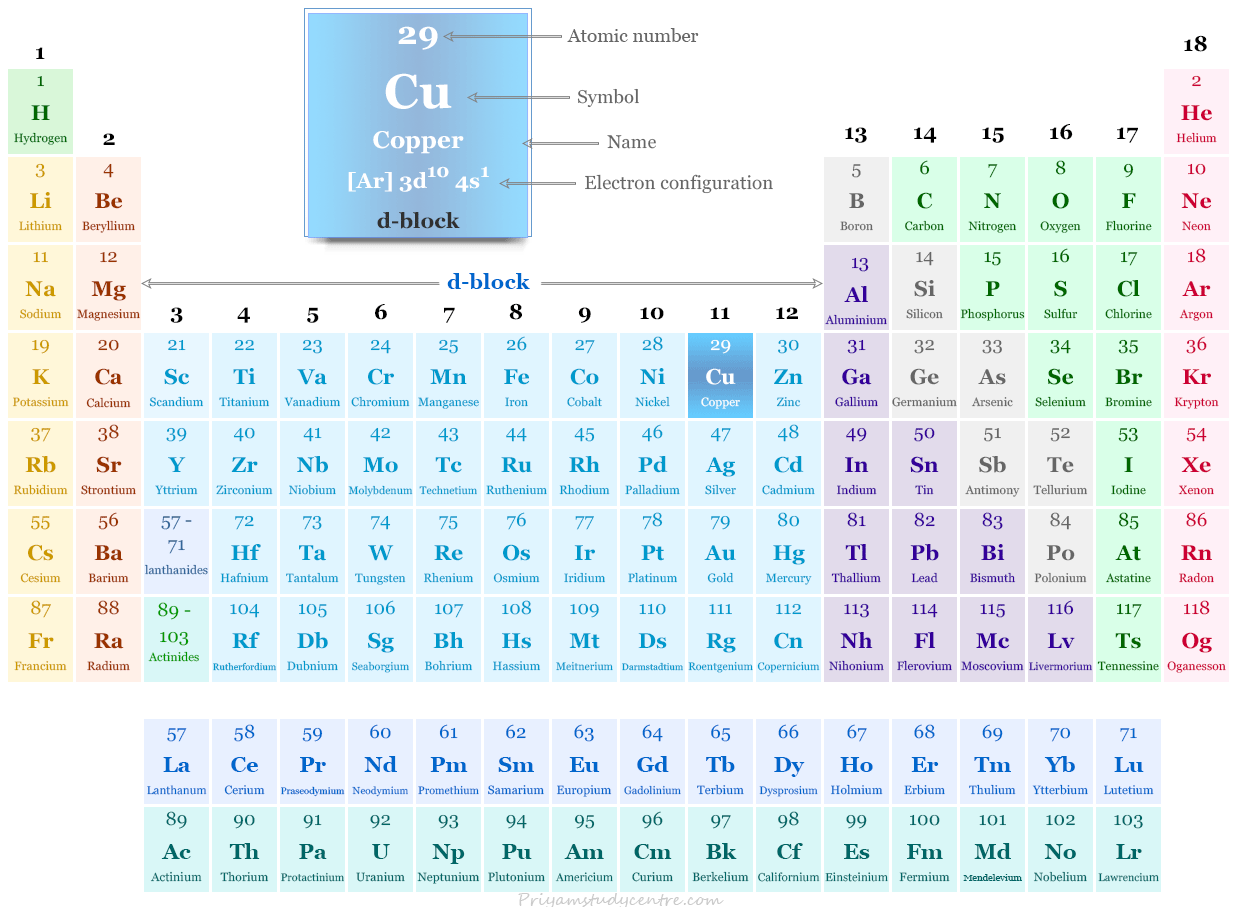
Cobre en la tabla periódica
Las monedas metal, cobre, plata y oro se ubican en el grupo-11 o grupo-1B de la tabla periódica.
 Oxigeno, Símbolo, Propiedades, Producción, Uso, Hechos
Oxigeno, Símbolo, Propiedades, Producción, Uso, HechosTodos estos metales contienen ns1 (n−1)d10 Configuración electrónica de capa de valencia con subcapa d llena. Debido a la presencia de la subcapa d llena de forma incompleta en un número o estado de oxidación de +2 o +3, se denominan metales de transición.
Propiedades químicas
En la tabla periódica temprana de Mendeleev, las monedas como Cu, Ag y Au se colocan con metales alcalinos. Tanto el metal alcalino como la moneda o moneda metálica tienen un electrón en el orbital s más externo y +1 es el número o estado de oxidación común.
Las propiedades físicas y químicas de estas dos familias son muy diferentes. Los metales alcalinos son elementos blandos, de bajo punto de fusión y altamente electropositivos, mientras que las monedas o los metales preciosos son metales de relativamente alto punto de fusión y relativamente menos electropositivos. Por lo tanto, los metales de monedas se colocan en el grupo 11 en la tabla periódica moderna.
Los metales del Grupo 11 tienen una primera energía de ionización alta y radios iónicos más pequeños. La participación de los electrones d en la unión de metales afecta un punto de fusión más alto del cobre.
El ion Cu(II) es más estable que el ion Cu(I) en solución acuosa. Se debe al tamaño pequeño y, por lo tanto, a la energía de hidratación enormemente alta de Cu (II) en relación con la de Cu (I), que compensa la segunda energía de ionización del cobre.
¿Dónde se encuentra el cobre?
El cobre está presente en la corteza terrestre hasta 68 ppm, que es un poco menos que el níquel.
El cobre nativo (minerales de hoja de basalto) y la forma reducida de compuestos metálicos como sulfuro, carbonatos, arseniuro y cloruro se encuentran en varios lugares del mundo.
Se encuentra principalmente en América del Norte o del Sur, Chile (el mayor productor del mundo), el Congo y las provincias rusas. En la India, dos grandes depósitos de mineral de Cu están presentes en Bihar (Singhbhum) y Rajasthan (Alwar, Ajmer y Khetri).
Minerales de cobre
Los principales minerales del metal se dan debajo de la tabla,
| mina de cobre | Fórmula química |
| calcopirita | CUFES2 |
| cuprita | Señal2O |
| covelita | CuS |
| Calcocita | Señal2s |
| Malaquita | [CuCO3, Cu(OH)2] |
| Bornita | 2 Cu2S, CuS, FeS |
| digninita | Señal9s5 |
| dioptasa | CuSiO2(OH)2 |
Proceso de Extracción de Cobre
Se extrae principalmente del mineral de sulfuro mediante el proceso de autorreducción. La baja calidad (0,5 por ciento Cu) oculta a la alta calidad (15 a 20 por ciento Cu) para la alta producción del metal. El proceso de flotación de espuma se utiliza para este propósito.
Los principales pasos para la extracción de cobre son,
Fusión de cobre
El mineral se tuesta y se funde (alrededor de 1400°C) con la adición de sílice en un horno de reverberación. El FeS se oxida preferentemente antes que el Cu.2S debido a las propiedades más básicas del hierro.
El óxido de hierro forma una escoria con sílice. La masa fundida se separa para formar la capa superior. La capa inferior contiene una estera de cobre (Cu2S y FeS).
Auto-reducción
- La estera fundida se oxida aún más con aire para oxidar el hierro restante.
- Se agrega más sílice, formando escoria que contiene óxido de hierro.
- Después de la eliminación de la escoria, el sulfuro metálico se oxida con aire a Cu. Dar forma2O que se combina con el Cu restante2S para producir cobre por autorreducción.
Señal2S + 2 Cu2O → 6 Cu + SO2
Refinación de Cobre por Electrólisis
El metal bruto se refina por electrólisis en un baño de solución de sulfato acidificado con Cu bruto como ánodo y Cu puro como cátodo. Las impurezas del ánodo se utilizan para recuperar oro, plata y platino.
Ingredientes químicos
En los estados +1 o +2, el cobre forma varios tipos de óxidos, hidróxidos, haluros, sulfatos, carbonatos, nitratos y compuestos complejos.
Estado de oxidación del cobre
El estado Cu(II) es el principal estado de oxidación del cobre metálico con d9 configuración. Cu(I) tiene la capa cerrada 3d10 configuración y altamente estabiliza por el intercambio de energía.
Los compuestos sólidos en el estado +1 son termodinámicamente estables a temperatura moderada. Por lo tanto, Cu2El O se forma a partir de CuO y CuBr a altas temperaturas.2 se descompone al calentarlo para formar CuBr.
Una gran cantidad de compuestos químicos se forman en los estados +1 y +2 del cobre metálico.
El Cu(III) es isoelectrónico con el níquel(II), pero solo se conocen unos pocos compuestos en este estado.
Óxidos de cobre
Los óxidos de cobre existen en dos formas, óxido de cobre negro (CuO) y óxido de cobre rojo (Cu2O) con estados de oxidación +2 y +1, respectivamente.
- El óxido de color negro (CuO) se forma calentando Cu con oxígeno. La descomposición térmica de carbonato, nitrato o hidróxido es la mejor manera de preparar el óxido de cobre.
- Óxido rojo de Cu(I) u óxido de cobre (Cu2O) se forma cuando las soluciones alcalinas de Cu(II) se reducen con agentes reductores suaves como la glucosa. Ocurre en la naturaleza como cuprita y se usa para hacer vidrio de rubí.
Hidróxido de cobre (II)
El precipitado azul de hidróxido de cobre (II) se obtiene añadiendo álcali a la solución acuosa de Cu (II). El precipitado se vuelve oscuro al reposar debido a la deshidratación del hidróxido a óxido. Es soluble en álcali para formar; [Cu(OH)4]−2.
En solución de amoníaco forma azul profundo [Cu(NH3)4(H2O)2]+2. La solución de color azul intenso se llama reactivo de Schweizer. Se utiliza para disolver celulosa y hacer rayón de cupramonio.
haluros de cobre
Solo el fluoruro blanco, el cloruro amarillo y el bromuro negro se conocen en un estado de oxidación +2. Debido a sus propiedades reductoras, el yodo reduce el CuI2 cu. Dar forma2yo2.
Los haluros hidratados se obtienen por CuCO. resolver3 o Cu(OH)2 en haluros de hidrógeno. CuF no está bien caracterizado.
Los otros haluros de Cu(I) son sólidos incoloros insolubles en agua. El cloruro de cobre se prepara por reducción de Cu(II) con cobre metálico o dióxido de azufre en ácido clorhídrico.
Sulfato y Nitrato
Sulfato de cobre (CuSO45H2O) se prepara disolviendo elementos macerados en ácido sulfúrico diluido en presencia de aire y cristalizando.
El nitrato se obtiene como un sólido cristalino delicuescente de color azul intenso, Cu(NO3)33H2O por la acción del ácido nítrico en solución de Cu(II).
Compuestos de Cobre (III)
Debido al mayor tamaño y al mayor valor de la suma de las energías de ionización primera, segunda y tercera, el Cu(III) forma algunos compuestos químicos.
No hay ejemplos simples de haluros sino verde claro K3CuF6 se puede obtener por la acción del flúor en una mezcla de cloruro de potasio y CuCl2 a 250°C.
Compuesto sólido de cuprato (III) como KCuO2 se forma calentando la mezcla de CuO con superóxido de metal alcalino en presencia de una molécula de oxígeno.
uso de cobre
- El cobre es un buen conductor de la electricidad y se usa ampliamente en la fabricación de alambres, cables, generadores, transformadores, motores y otros equipos eléctricos.
- También se utiliza para fabricar utensilios, pipas y monedas.
- Las aleaciones de cobre como el latón, el bronce, el constantán, la manganina y el metal monal se utilizan ampliamente en diversos fines domésticos e industriales debido a su alta resistencia mecánica y resistencia a la corrosión.
Uso de aleaciones de cobre.
El latón es una aleación de cobre. Se obtiene aleando cobre con zinc y otros metales como aluminio, níquel y plomo.
En general, contiene de 57 a 97 por ciento de Cu y el resto es Zn u otros metales que alteran la resistencia mecánica y las propiedades químicas.
El latón se usa principalmente en electrodomésticos, estatuas, hélices de barcos y cojinetes.
| Aleación de cobre | |
| Aleación | Composición |
| Latón | 70% Cu y 30% Zn |
| Muntz metal | 60% Cu y 40% Zn |
| metal delta | 55% Cu, 40% Zn y 5% Fe |
Delta metal es tan duro como el acero y resistente al agua de mar. Se utiliza para fabricar hélices y cojinetes marinos.
uso de bronce
El bronce es la aleación de cobre, estaño y otros metales como aluminio, manganeso y zinc, etc. El bronce generalmente contiene de 4 a 25 por ciento de estaño y otros elementos.
Es ampliamente utilizado para hacer estatuas y monedas. Hoy en día, estas aleaciones están siendo reemplazadas gradualmente por acero y otras aleaciones a base de aluminio más baratas y livianas.
cuproníquel
El cuproníquel (10 a 30 por ciento de níquel y el resto es cobre) tiene una alta resistencia a la tracción y es resistente a la corrosión química, al óxido y al ácido.
El cuproníquel se usa ampliamente en plantas químicas, sistemas telefónicos, álabes de turbinas, etc.