¿Qué es Krypton?
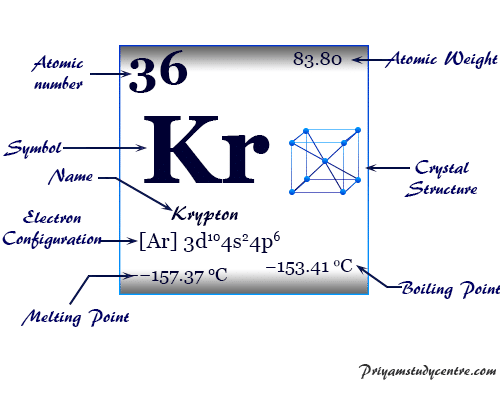
Criptón es un elemento químico, gas inerte o gas noble del grupo 18 de la tabla periódica con el símbolo kr y el número atómico 36. Ocurre en pequeñas cantidades en el ambiente de la Tierra y se usa en lámparas fluorescentes junto con otros gases nobles.
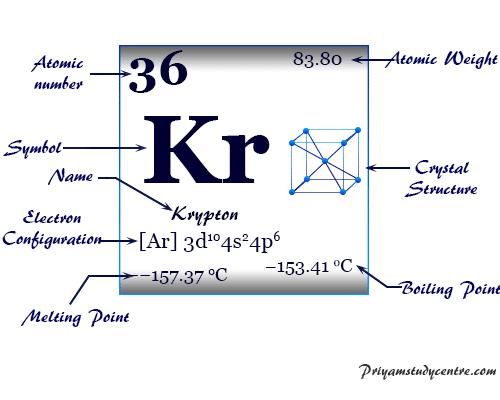
El criptón es un gas monoatómico incoloro, inodoro e insípido que forma una serie de compuestos químicos con el flúor. Debido al orbital de valencia lleno, el número de oxidación o estado de oxidación es cero, pero con flúor, el criptón también exhibe un estado de oxidación +2. Se coloca en el bloque p de la tabla periódica con los miembros del grupo helio, neón, argón, xenón y radón.
Lectura relacionada: Neon, Propiedades, Uso, Conexiones, Hechos
Neon, Propiedades, Uso, Conexiones, HechosDescubrimiento de criptón
Krypton fue descubierto en 1898 por los químicos británicos Sir William Ramsay y Morris W. Travers y el nombre del gas se deriva del último griego kryptos, que significa oculto.
El análisis del espectro electromagnético de Krypton se caracteriza por varias emisiones nítidas de líneas verdes y amarillas en el espectro. En estado sólido, forma una red cristalina cúbica centrada en las caras y la estructura compacta cúbica es la que más espacio ahorra.
Propiedades del criptón
El gas noble Kr tiene una configuración electrónica de capa de valencia [Ar] 3d10 4s2 3p6y relación de capacidad calorífica (Cp/Cv) cercana a 1,66. Se encuentra en la atmósfera terrestre hasta en un 0,0001 por ciento y se obtiene por destilación de aire líquido a baja temperatura.
Lectura relacionada: Vanadio, Propiedades, Producción, Conexiones, Uso
Vanadio, Propiedades, Producción, Conexiones, Uso| criptón | ||||
| Símbolo | kr | |||
| Descubrimiento | Sir William Ramsay y Morris Travers en 1898 | |||
| Nombre derivado de | palabra griega kryptos, que significa oculto | |||
| isótopo común | 84kr | |||
| estructura cristalina | Enrejado cristalino cúbico centrado en la cara | |||
| Propiedades periódicas | ||||
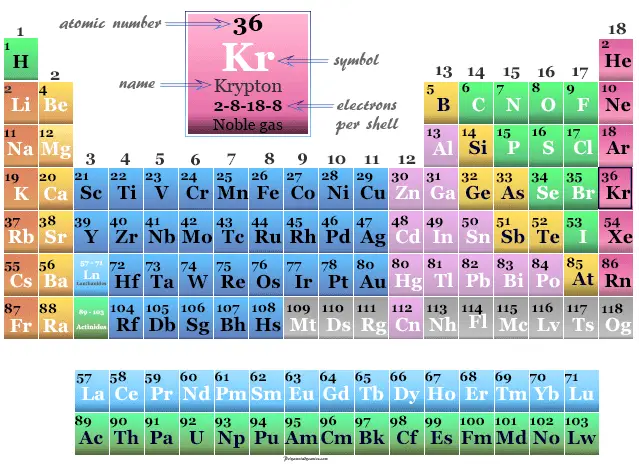
| número atómico | 36 | |||
| electrón por escala | 2, 8, 18, 8 | |||
| Peso atomico | 83,798 | |||
| Configuración electrónica | [Ar] 3d10 4s2 4p6 | |||
| Grupo | 18 (gases nobles) | |||
| Período de tiempo | 4 | |||
| Bloquear | bloque p | |||
| Características físicas | ||||
| Condición a 20 °C | Gas | |||
| Punto de fusion | −157,37 °C, −251,27 °F, 115,78 K | |||
| Punto de ebullición | −153,41 °C, −244,15 °F, 119,735 K | |||
| Espesor | 0.003425 gcm−3 | |||
| Propiedades químicas | ||||
| Radio atómico (sin consolidar) | 2.02 | |||
| Radio covalente | 1.16 | |||
| número de oxidación o estados | 0 | |||
| Energía de ionización (kJ/mol) | 1º | 2do | 3ro | |
| 1350.76 | 2350.37 | 3565.13 | ||
| Afinidad electronica | Desconocido | |||
| Electronegatividad | 3,00 (escala de Pauling) | |||
| Capacidad calorífica molar |
20,95 J mol−1 k−1 | |||
| número CAS | 7439-90-9 | |||
Isótopos de Kr
El criptón natural tiene seis isótopos como: 84kr (57 por ciento), 86kr (17,3 por ciento), 82Kr (11,6 por ciento), 83Kr (11,5 por ciento), 80Kr (2,25 por ciento), y 78kr (0,35 por ciento). También formó unos treinta y seis isótopos radiactivos inestables obtenidos por fisión de uranio o alguna otra reacción nuclear.
Lectura relacionada: Hierro, historia, propiedades, hechos, uso, función.
Hierro, historia, propiedades, hechos, uso, función.- 78Kr (vida media 9,2 x 1021 años) es un isótopo estable entre todos los isótopos formados por reacción de desintegración radiactiva.
- 85Kr (vida media 10,76 años) se produce normalmente por la fisión de uranio y plutonio, que también se libera durante el reprocesamiento del reactor nuclear.
- Los isótopos radiactivos 81Kr se utilizan para datar las aguas subterráneas.
Ingredientes químicos
La química del criptón u otros gases nobles como el helio, el neón y el argón difiere de otros elementos de la tabla periódica debido a su configuración de capa de valencia llena y su alta energía de ionización. Pero formó algunos compuestos químicos inestables con flúor junto con clatratos o compuestos de jaula. Los clatratos o compuestos de jaula se forman principalmente con agua y paraquinol al atrapar moléculas de criptón en la red de enlaces de hidrógeno.
Difluoruro de criptón
El único compuesto de haluro inestable conocido es el difluoruro de criptón (KrF2). El compuesto de gas noble KrF2 se puede preparar pasando una descarga eléctrica de baja presión a través de una mezcla de moléculas de criptón y flúor en un tubo en U sumergido en oxígeno líquido. También se forma por la acción de OF2 en Kr en presencia de la luz del sol.
El compuesto químico KrF2 es menos estable que XeF2 y se disocia en Kr y F2 a temperatura ambiente. KrF2 utiliza un agente fluorante que fluora el xenón o metales preciosos como la plata y el oro. Una mezcla de KrF2 y XeF2 muchos compuestos de lantánidos trivalentes fluorados como LnF4LnF73, y LnOF2donde Ln = Ce, Pr, Nd, Tb y Dy.
Estructura de difluoruro de criptón
Un forro KrF2 tiene una estructura similar a la de XeF2 con la distancia de enlace Kr-F de 189 pm. La energía de enlace Kr-F es de aproximadamente 50 kJ mol−1que es el valor más bajo de energía de enlace para el enlace químico formado por cualquier elemento con flúor.
Se unió al nitrógeno en la sal, HCHKrF2+[AsF6] que fue hecho por KrF. responder2 con HCN+[AsF6] en solución de fluoruro de hidrógeno.
Por ejemplo, también se conocen otros aductos de nitrilo de criptón. [RC≡NKrF]+donde R = Yo, CF3C2F5y nC3F5. El enlace Kr-O también ocurre en el compuesto térmicamente inestable como Kr (OTeF5)2.
Uso de criptón

- Krypton es ampliamente utilizado en la electrónica, como lámparas y tubos fluorescentes. Cuando una corriente de corriente pasaba a través de un tubo de vidrio que contenía criptón, emitía una luz blanca azulada comúnmente utilizada en la lámpara de flash de la fotografía de alta velocidad. Se mezcla con mercurio para producir el resplandor de una luz azul verdosa brillante. En las lámparas fluorescentes de bajo consumo utilizamos una mezcla de criptón y argón para ahorrar energía.
- El compuesto químico inestable, fluoruro de criptón (KrF2) se utiliza en láseres para varios tipos de experimentos de fusión nuclear.
- El criptón y sus isótopos también se utilizan en diversos tipos de investigación, desde física y química de partículas, imágenes por resonancia magnética y medicina nuclear.