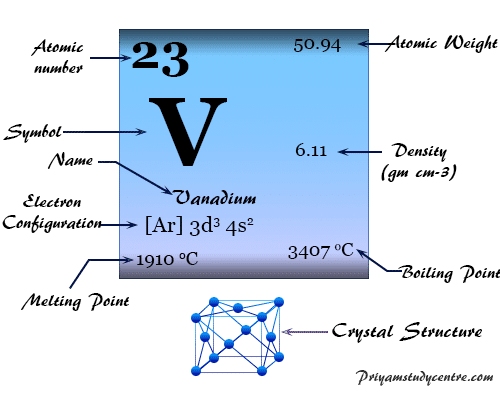
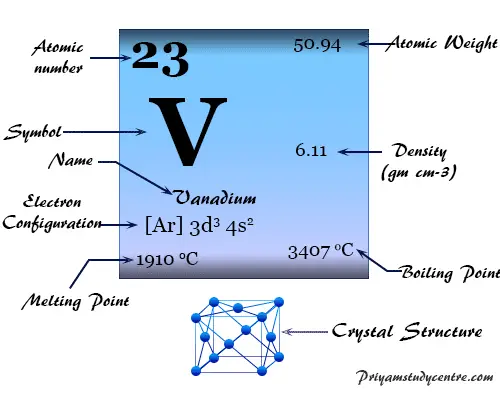
Elemento Vanadio
Vanadio es un elemento químico o metal de transición blanco plateado brillante, de baja densidad, del grupo 5 (VIB) de la tabla periódica con símbolo V y número atómico 23. Es ampliamente utilizado para hacer aleaciones.
El metal está aleado con acero y otros metales como hierro, cobre, níquel y aluminio. Estas aleaciones se utilizan para fabricar resortes y herramientas de alta velocidad.
Lectura relacionada: Hierro, historia, propiedades, hechos, uso, función.
Hierro, historia, propiedades, hechos, uso, función.El metal de vanadio puro es blando, maleable y maleable, pero las impurezas lo hacen duro y quebradizo.
Propiedades del vanadio
En la red cristalina cúbica brillante blanca, el vanadio tiene la configuración electrónica de la capa de valencia [Ar] 3d3 4s2. El punto de fusión y la densidad del vanadio son más altos que los del titanio, lo que sugiere una mayor participación del electrón d en los enlaces químicos metálicos.
Tiene el punto de fusión más alto en la primera serie de transición con un número de oxidación estable de +5 o un estado que no está muy oxidado.
Lectura relacionada: Azufre, Hechos, Propiedades, Producción, Uso
Azufre, Hechos, Propiedades, Producción, Uso| Vanadio | |||
| Símbolo | V | ||
| Descubrimiento | Andrés Manuel del Río en 1801 | ||
| Nombre derivado de | Na Vanadis, el antiguo nombre nórdico de la diosa escandinava Freyja | ||
| isótopo común | 23V51 | ||
| Estados de oxidación | +5, +4+3, +2, 0 | ||
| número CAS | 7440-62-2 | ||
| Propiedades periódicas | |||
| número atómico | 23 | ||
| Masa atómica relativa | 50,942 | ||
| electrón por celda | 2, 8, 11, 2 | ||
| Configuración electrónica | [Ar] 3d3 4s2 | ||
| Bloquear | bloque d | ||
| Grupo | 5 | ||
| Período de tiempo | 4 | ||
| Características físicas | |||
| Condición a 20 °C | firma | ||
| Punto de fusion | 1910 °C, 3470 °F, 2183 K | ||
| Punto de ebullición | 3407°C, 6165°F, 3680K | ||
| Capacidad calorífica molar | 24,89 J mol−1 k1 | ||
| estructura cristalina | cúbico centrado en el cuerpo (bcc) | ||
| Espesor | 6,11 g/cm3 | ||
| Resistencia eléctrica | 197 nm | ||
| Propiedades atómicas | |||
| Radio atómico (sin consolidar) | 2.07 | ||
| Radio covalente | 1.44 | ||
| Electronegatividad | 163 (escala de Pauling) | ||
| Afinidad electronica | 50.655 kJ mol−1 | ||
| Energía de ionización (kJ/mol) | 1º | 2do | 3ro |
| 650.91 | 1410.42 | 2828.08 | |
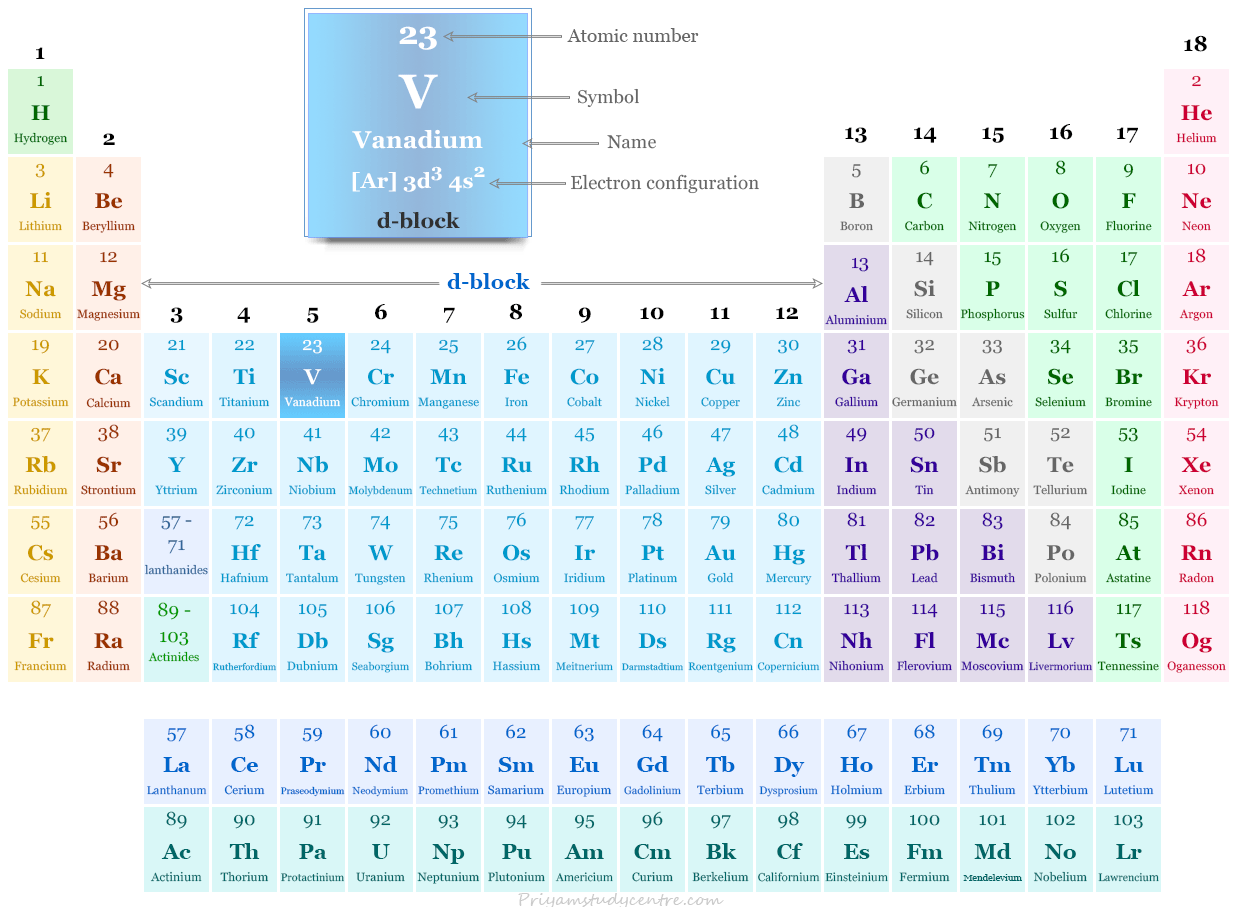
Vanadio en la tabla periódica
Se coloca en el grupo 5 y el período 4 de la tabla periódica. El vanadio es un metal de transición que se encuentra entre el titanio y el cromo.
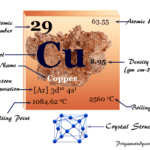 Cobre, Hechos, Símbolo, Propiedades, Conexiones, Uso
Cobre, Hechos, Símbolo, Propiedades, Conexiones, Uso¿Quién descubrió el vanadio?
La presencia de un nuevo elemento en algunos minerales de plomo mexicanos fue descubierta por primera vez por el mineralogista español Andrés Manuel del Río en 1801. Lo llamó erythronium del griego erythos, que significa rojo.
En 1830, el químico sueco Nils Gabriel Sefström encontró el mismo elemento en el mineral de hierro sueco que producía diferentes tipos de compuestos con una variedad de hermosos colores. Por eso nombró al elemento químico vanadio según la diosa escandinava de la belleza, Vanadis.
El químico inglés Henry Enfield Roscoe aisló por primera vez el metal en 1831 mediante la reducción con hidrógeno del cloruro de vanadio (VCl2).
En 1925, el químico estadounidense John Wesley Marden y Malcolm N. Rich prepararon la forma pura del metal (99,7 por ciento) mediante la reducción de pentóxido de vanadio (V2O5) con cal.
¿Dónde se encuentra el vanadio?
El vanadio es el quinto metal de transición más abundante y el vigésimo elemento más abundante de todos los elementos de la tabla periódica. Presenta el 0,0136 por ciento de las rocas de la corteza terrestre.
Varios minerales (carnotita, vanadinita, roscoelita), el carbón y el petróleo crudo son la principal fuente de vanadio. Se encuentra comercialmente en varios países como Venezuela, México, China, Sudáfrica y Rusia.
Algunas fuentes de agua mineral y ciertos invertebrados y plantas tienen una alta concentración de vanadio en sus cuerpos.
Proceso de producción
El vanadio se obtiene como subproducto en la producción de uranio a partir de carnotita.
- El mineral molido y concentrado se tuesta al aire y se lixivia con una solución de carbonato de sodio para producir carbonato de uranilo de sodio y vanadato de sodio.
- Los compuestos mixtos se separan en el filtrado.
- El filtrado que contiene vanadato de sodio se trata con amoníaco o cloruro de amonio para precipitar el vanadato de amonio naranja. OTAN3 + NH4Cl → NH4VO3 + NaCl
- Alternativamente, la solución de vanadato de sodio se acidificó con ácido sulfúrico diluido (escala de pH de 2 a 3) para precipitar el polivanadato.
- El vanadato de amonio se enciende para producir pentóxido negro (V2O5), color negro debido a la presencia de impurezas.
- El óxido se usa principalmente (90 por ciento) para fabricar acero de ferrovanadio.
- El vanadio metálico se puede obtener del óxido por reducción con calcio caliente en una atmósfera inerte.
Proceso de purificación
El metal se purifica por conversión a VCl.4 seguido de reducción con magnesio. Una forma muy pura de vanadio se obtiene por pirólisis de VI3 (proceso van Arkel).
La mayor parte del pentóxido de vanadio comercial (V2O5) se convierte en ferrovanadio, una aleación que contiene un 50 por ciento de hierro.
Propiedades químicas del vanadio
El vanadio tiene un total de cinco electrones en orbitales de valencia y exhibe todos los estados de oxidación +1 a +5, de los cuales +2 y +5 son estables e importantes en química.
La química acuosa se caracteriza por especies poliméricas comúnmente conocidas como isopolivandatos. V (IV) es más estable en condiciones normales, representado por los haluros y los iones de vanadilo (VO+2).
V(II) es un agente reductor más suave que Ti(III) y estable en solución acuosa. En el estado de oxidación +1, es de naturaleza altamente reductora y se oxida rápidamente en el aire y el agua.
Ingredientes químicos
óxido de vanadio
Pentóxido de vanadio (V2O5) es un catalizador químico comercialmente importante utilizado para la producción de ácido sulfúrico y electrodos en baterías redox.
Los óxidos inferiores se obtienen calentando metal con exceso de oxígeno. El óxido de vanadio puro es un sólido cristalino naranja (punto de fusión 670 °C), pero la variante técnica es marrón.
haluros
Al aprender química, el haluro de vanadio contiene la fórmula química VXnorte (donde X = haluros), pero VI4VCI5VBr5y VI5 extremadamente inestable o inexistente.
FV5 es el único pentahalogenuro en el estado +5 preparado calentando el metal con flúor a 300°C o desproporción de VF4. Es un agente oxidante y fluorante violento.
Se preparan tres tetrahaluros de vanadio en el estado +4 por reacción directa del metal con flúor, cloro o bromo. Actúan como un aducto de ácido de Lewis a través de bases como SeF4NUEVA HAMPSHIRE3y piridina.
En los estados +2 y +3, todos los di- o tetrahaluros son estables a temperatura ambiente.
Oxohalogenuros
Forma todos los oxohaluros con la fórmula química VOmetroXnorte. El oxitrifluoruro se puede preparar por VF. responder5 con aire
VOCl3 y VOBr3 son los óxidos de metal más comunes e importantes obtenidos por la acción del Cl2 o hermano2 en V2O5 o una mezcla de V2O5 y carbono.
Compuestos organometálicos
En química organometálica, el vanadio forma complejos tipo sándwich con ciclopentadieno y benceno. El vanadoceno es un sólido violeta-negro paramagnético ampliamente utilizado en química orgánica.
Cuando VCl33THF se trata con un gran exceso de litio fenilo en éter, el complejo púrpura Li4[]vph63.5 Et2se obtiene O.
¿Para qué se usa el vanadio?
- El vanadio se usa principalmente en acero aleado para fabricar resortes industriales y herramientas de alta velocidad en las industrias aeroespacial y de defensa.
- Un pequeño porcentaje (0,1 a 0,3 por ciento) de metal de vanadio se combina con el carbono en el acero para formar carburos finamente dispersos como V4C3 lo que aumenta la resistencia mecánica de la aleación a alta temperatura.
- El acero al cromo vanadio es muy adecuado para fabricar ejes, ejes y bastidores de automóviles. Se forman aleaciones útiles con otros metales como cobre, níquel, aluminio, etc.
- En la central nuclear, el vanadio o sus compuestos es un material adecuado para construir la estructura del reactor de fusión nuclear.
- Es un buen secuestrante en operaciones metalúrgicas para eliminar los últimos restos de moléculas de oxígeno.
- El vanadio y sus compuestos de óxido se utilizan ampliamente como catalizador químico en química orgánica e inorgánica, para la oxidación de naftaleno a ácido ftálico, tolueno a benzaldehído, hidrogenación de alquenos u olefinas e hidrocarburos aromáticos.