Elemento Flúor
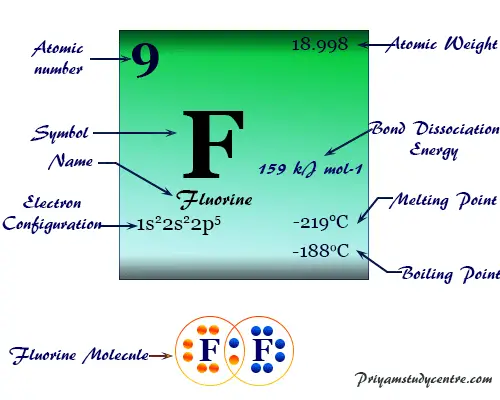
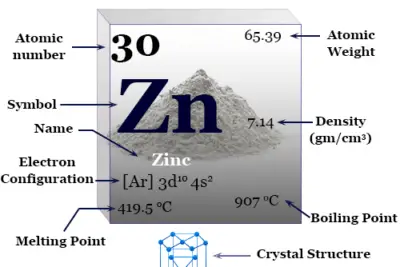
Flúor (símbolo químico) F), fórmula química F2. El número atómico 9 es el miembro más electronegativo y químicamente más reactivo de la familia de los halógenos o grupo 17 del elemento de la tabla periódica.
Debido a su alta reactividad y pequeño tamaño, el flúor se combina directamente con el metal, casi todos los no metales y los gases nobles. Las reacciones con muchos elementos son violentas ya veces explosivas. La reactividad excepcionalmente alta del flúor se atribuye a la baja energía de enlace FF (159 kJ mol−1). Disminuye paulatinamente en otros miembros del grupo (cloro, bromo y yodo).
Lectura relacionada: Nitrogeno, descubrimiento, producción, uso y fijación.
Nitrogeno, descubrimiento, producción, uso y fijación.flúor en la tabla periódica
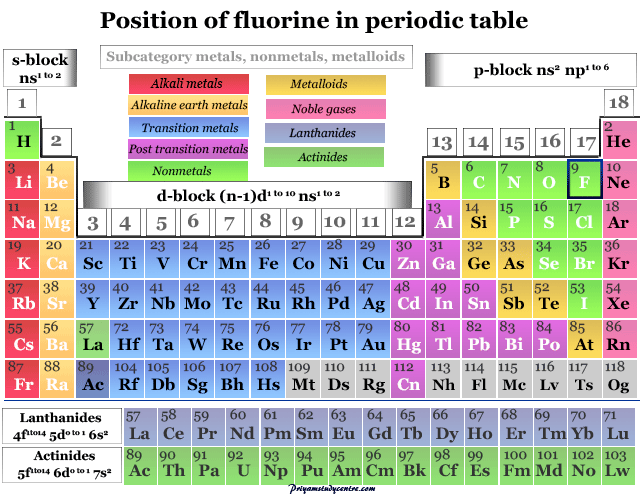
Se coloca en el grupo 17 (VIIB) en la tabla periódica con la familia de los halógenos. La química y la posición de la tabla periódica de los halógenos siguen su configuración electrónica. Todos los elementos tienen siete electrones en los orbitales de valencia.
Lectura relacionada: Oxigeno, Símbolo, Propiedades, Producción, Uso, Hechos
Oxigeno, Símbolo, Propiedades, Producción, Uso, Hechos¿Quién descubrió el flúor?
El nombre del elemento químico flúor proviene del mineral fluorita (CaF2) propuesta por el físico francés André-Marie Ampère en una carta a Davy (1812).
En 1771, el químico sueco Carl Wilhelm Scheele descubrió compuestos corrosivos de ácido fluorhídrico (HF) al calentar espato flúor con ácido sulfúrico concentrado en una retorta de vidrio, pero no pudo usarse para aislar el flúor debido a varios problemas.
Durante más de 150 años, todos los métodos de preparación química no tenían F. producido2el éxito del descubrimiento se produjo en 1986 por el químico estadounidense Karl O. Christe a través de la reacción de K2MnF6 y pentafluoruro de antimonio (SbF5). Ambos compuestos químicos se obtienen mediante el uso de fluoruro de hidrógeno.
Lectura relacionada: Hidrogeno, Símbolo, Propiedades, Isótopos, Hechos, Uso
Hidrogeno, Símbolo, Propiedades, Isótopos, Hechos, UsoPrevención del flúor
Ninguno de los halógenos se encuentra libre en la naturaleza debido a su alta reactividad. Ocurre en la corteza terrestre en un grado de 0,065 por ciento (544 ppm; decimotercero en abundancia), que es mayor que el del cloro (0,055 por ciento, 126 ppm, vigésimo en abundancia).
Los minerales más comunes que se encuentran en el medio ambiente terrestre, concentrados con elementos de flúor, son la fluorita o espato flúor (CaF2), criolita (Na3alF6) y fluorapatita[3Ca3(PO4)2, CaF2].
¿Dónde se encuentra el flúor?
Los principales minerales fluorados (espato flúor) se encuentran en varias partes del mundo, como India, Illinois, Kentucky, Derbyshire, el sur de Alemania, el sur de Francia y Rusia. Groenlandia es la principal fuente de criolita similar a un mineral ( Na3alF6). En India, la fluorita se encuentra en Chhattisgarh (Drug, Raipur y Jabalpur) en Rajasthan (Jaipur, Ajmer y Kishangarh).
Proceso de producción
Preparación de flúor por electrólisis.
El químico francés Henri Moissan 1886 preparó flúor por electrólisis de fluoruro de potasio (KF) con ácido fluorhídrico anhidro en un tubo en U de platino con un electrodo de platino-iridio. Fue galardonado con el Premio Nobel de Química en 1906 por la producción de elementos químicos. Debido a sus propiedades tóxicas, el progreso de la química del flúor es muy lento.
Flúor a partir de fluoruro de hidrógeno
El ácido fluorhídrico anhidro no es conductor de electricidad, mientras que una solución acuosa produce oxígeno ozonizado en la electrólisis. Ningún agente químico oxidante fue capaz de oxidar un compuesto de fluoruro o ácido fluorhídrico.
La descomposición de los compuestos de fluoruro da flúor gaseoso, pero el proceso es improbable desde un punto de vista termodinámico, ya que los compuestos tienen una red o energía de enlace alta.
Ahora se prepara por electrólisis de una mezcla fundida de fluoruro de potasio y ácido fluorhídrico en una celda blanda que actúa como cátodo y el ánodo es la varilla central de carbono sin grafito separada del cátodo por el diafragma poroso.
Características físicas
El flúor es un gas amarillo verdoso tenue a una temperatura ordinaria que se convierte en un líquido amarillo al enfriarse. Tiene un solo isótopo estable. 19F o F-19. En estado de vapor, normalmente existe como una molécula diatómica (F2) con un punto de fusión de -219 °C y un punto de ebullición de -188 °C. La molécula F2 está formada por una débil atracción de Van der Waals. En la fase sólida forma capas de la red cristalina.
| flúor | ||||
| Símbolo | F | |||
| Descubrimiento | Henri Moissan en 1886 | |||
| Nombre derivado de | Palabra latina flure, que significa fluir | |||
| isótopo común | 19F | |||
| estructura cristalina | Red cristalina cúbica | |||
| Propiedades periódicas | ||||
| número atómico | 9 | |||
| electrón por escala | 2, 7 | |||
| Peso atomico | 18,998 | |||
| Configuración electrónica | [He] 2s2 2p5 | |||
| Grupo | 17 (halógeno) | |||
| Período de tiempo | 2 | |||
| Bloquear | bloque p | |||
| Características físicas | ||||
| Condición a 20 °C | Gas | |||
| Punto de fusion | −219,67 °C, −363,41 °F, 53,48 K | |||
| Punto de ebullición | −188,11 °C, −306,6 °F, 85,04 K | |||
| Espesor | 0,001553 g·cm−3 | |||
| Propiedades químicas | ||||
| Radio atómico (sin consolidar) | 1.47 | |||
| Radio covalente | 0,60 | |||
| número de oxidación común o estados | −1 | |||
| Energía de ionización (kJ/mol) | 1º | 2do | 3ro | |
| 1681.04 | 3374.17 | 6050.44 | ||
| Afinidad electronica | 328.165 kJ mol−1 | |||
| Electronegatividad | 3,98 (escala de Pauling) | |||
| Capacidad calorífica molar |
Cpags: 31 J mol−1 k−1 a 21,1 ºC Cv: 23 J mol−1 k−1 a 21,1 ºC |
|||
| número CAS | 7782-41-4 | |||
Propiedades químicas
El flúor es el elemento químico más electronegativo de la tabla periódica de los elementos. Siempre asigna un número de oxidación -1 e introduce polaridad en las moléculas de fluoruro de hidrógeno. Las moléculas de fluoruro de hidrógeno están conectadas a través de enlaces de hidrógeno intermoleculares. La química y la posición de la tabla periódica del flúor se pueden describir por la configuración electrónica que tiene un electrón por debajo del próximo gas noble.
Datos sobre el flúor
Algunos de los hechos interesantes sobre los halógenos superiores solo pueden explicarse considerando la participación de los orbitales d en los enlaces químicos. A continuación se explican algunos datos sobre el flúor,
- La estructura electrónica del gas noble del átomo de flúor se logra de dos formas, tomando un electrón de un entorno reactivo para formar un ion o formando un par compartido en un enlace covalente. Tiende a aceptar un electrón debido a su alta afinidad electrónica y energía de ionización.
- Asegura el máximo número de coordinación de otros elementos debido al pequeño tamaño del átomo y la electronegatividad extremadamente alta.
Ambos hechos permiten un número máximo de pequeños átomos de flúor sin acumular una densidad de carga excesiva en los átomos centrales como el SF.6OSF6, [SiF6]2−SI7etc.
¿Para qué sirve el flúor?
- Mínimo 10.000 toneladas de gas flúor (F2) produce anualmente en todo el mundo que se utiliza en la fabricación de UF6 en plantas de energía nuclear, al hacer SF6 dieléctricos y agentes fluorantes como ClF3BrF3etc.
- Tungsteno (W) y renio (Re) fluorados a WF volátil6 y referencia6 requerido para la deposición de vapor de metales en piezas de máquinas
- La criolita sintética tiene un compuesto químico muy importante que tiene amplias aplicaciones industriales. El compuesto químico fluorita se utiliza como fundente en la metalurgia.
- Los compuestos químicos del flúor, como el fluoruro de hidrógeno (HF), el clorofluorocarbono (CFC) y el trifluoruro de boro (BF3) son ampliamente utilizados en la industria y la síntesis de compuestos orgánicos.