Elemento Hidrógeno
Hidrógeno es el único elemento químico de la tabla periódica en el que el electrón de valencia está directamente influenciado por el núcleo o no hay electrón de protección. Tiene el símbolo H y la fórmula molecular' H2. La molécula de hidrógeno es un gas incoloro, inodoro, insípido e inflamable que se ha utilizado para la producción de agua en los primeros tiempos.
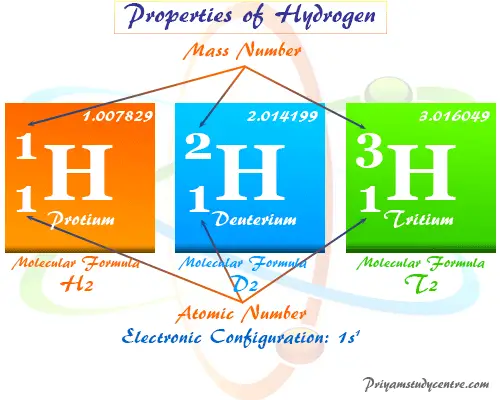
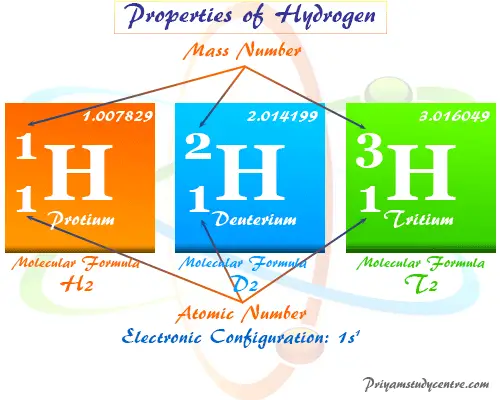
El hidrógeno tiene los tres isótopos con el nombre químico protium (1¿eh?1), deuterio (1¿eh?2), y tritio (1¿eh?3). El hidrógeno atómico tiene un modelo estructural muy simple. Contiene un electrón y un protón con número atómico = 1 y peso atómico o masa = 1.007829.
Lectura relacionada: Rodio - metal, precio, uso
Rodio - metal, precio, usoEn condiciones normales, debido a la presencia de un electrón de valencia en el orbital 1s, forma una gran cantidad de enlaces químicos comunes, como enlaces covalentes, iónicos, de puente y de hidrógeno.
¿Dónde se encuentra el hidrógeno?
En 1766, Henry Cavendish, un químico y físico inglés, descubrió el elemento o molécula más combustible como el hidrógeno. El nombre hidrógeno se deriva del origen de las palabras griegas que significan 'fabricante de agua'.
Además del estado físico general de la materia, como sólido, líquido y gas en el universo de la Tierra, el hidrógeno es una molécula de gas a temperatura ambiente. Es el tercer elemento químico más abundante después del oxígeno y el silicio y la segunda molécula de gas más abundante después del oxígeno.
Lectura relacionada: Lutecio, Uso, Símbolo, Hechos, Precio
Lutecio, Uso, Símbolo, Hechos, PrecioPosición del hidrógeno en la tabla periódica
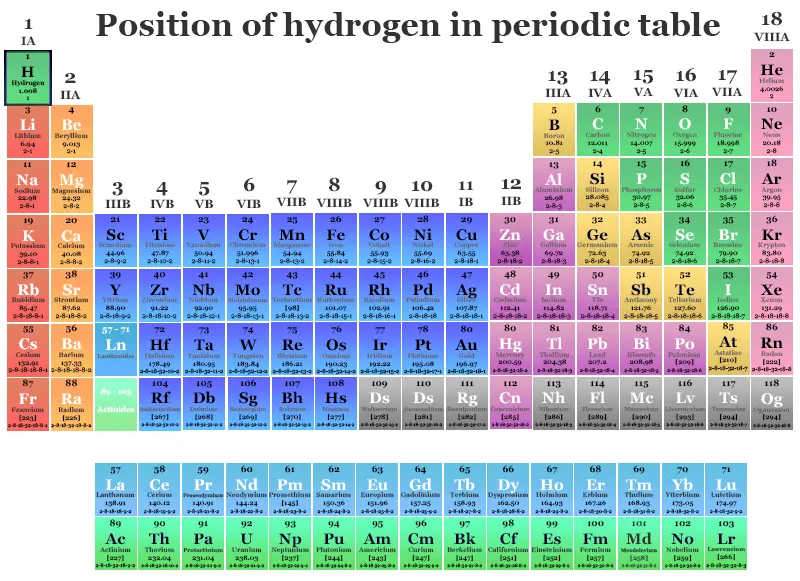
- el ns1 La configuración electrónica del hidrógeno justifica su posición en el período 1 y el grupo 1 con la familia de los metales alcalinos (litio, sodio, potasio, rubidio, cesio y francio). La energía de ionización del hidrógeno también es comparable a la de los metales alcalinos.
- Si consideramos la configuración electrónica del hidrógeno, es solo un electrón menos que el siguiente gas noble, el helio. Por lo tanto, se puede colocar en el grupo 17 con la familia de los halógenos como el flúor, el cloro, el bromo y el yodo. Todos estos elementos tienen electronegatividad y afinidad electrónica muy altas.
- Debido a la presencia de electrones de valencia medio llenos, el hidrógeno también se coloca en el grupo 14 con la familia del carbono al formar una gran cantidad de enlaces químicos covalentes con una amplia gama de polaridades.
El número de oxidación más común del hidrógeno = +1, pero debido a sus propiedades únicas, también muestra un estado de oxidación -1 para formar LiH, NaH, CsH y CaH.2.
Lectura relacionada: Tulio - Elemento, Símbolo, Uso, Hechos
Tulio - Elemento, Símbolo, Uso, HechosIsótopos de hidrógeno
El hidrógeno tiene los tres isótopos con nombre químico protio, deuterio y tritio y fórmula química 1¿eh?1, 1¿eh?2y 1¿eh?3 respectivamente.
Estos tres isótopos forman tres moléculas de gas covalente como dihidrógeno, dideuterio y ditritio. Estos isótopos se utilizan como combustibles alternativos para motores o fuentes de energía renovables para nuestro medio ambiente.
propiedades del hidrogeno
| Hidrógeno |
|
| Símbolo | ¿eh? |
| Descubrimiento | Henry Cavendish en 1766 |
| Nombre derivado de | Las palabras griegas hydro y genes, que significan formación de agua |
| alótropo | ¿eh?2 |
| isótopo común | 1¿eh?2 (deuterio), 1¿eh?3 (tritio) |
| estructura cristalina | Red cristalina hexagonal |
| Propiedades periódicas | |
| número atómico | 1 |
| electrón por escala | 1 |
| Peso atomico | 1.08 |
| Configuración electrónica | 1s1 |
| Grupo | 1 |
| Período de tiempo | 1 |
| Bloquear | bloque s |
| Características físicas | |
| Condición a 20 °C | Gas |
| Punto de fusion | -259,16 °C, -434,49 °F, 13,99 K |
| Punto de ebullición | -252,88 °C, -423,18 °F, 20,27 K |
| Espesor | 0,000082 gcm−3 |
| Propiedades químicas | |
| Radio atómico (sin consolidar) | 1.10 |
| Radio covalente | 0.32 |
| número de oxidación o estados | 1, −1 |
| Energía de ionización | 1º: 1312,05 kJ mol−1 |
| Afinidad electronica | 72.769 kJ mol−1 |
| Electronegatividad | 2.19 (escala de Pauling) |
| Capacidad calorífica molar |
28.836 J mol-1 k-1 |
| número CAS | 133-74-0 |
Datos sobre el hidrógeno
El hidrógeno es un tipo único de elemento químico que no existe libremente en la atmósfera terrestre, pero se usa ampliamente en la vida cotidiana. La energía cinética de H2 moléculas a la temperatura de la Tierra es suficiente para escapar de la gravedad de la Tierra. Por lo tanto, la densidad de H. es2 disminuye en nuestro entorno.
El hidrógeno molecular es una especie muy estable y no reactiva debido a su alta energía de enlace, pero la forma atómica es la especie más reactiva. Sólo el uno por ciento de las formas atómicas están presentes en el H2 molécula de gas
La vida media de la forma atómica es de casi 1 segundo a una presión de 0,2 mm. Un enorme calor específico (432,6 kJ mol−1) utilizado para la recombinación de H atómico. Este proceso se utiliza para la soldadura a alta temperatura de metales de tantalio y tungsteno.
Debido a su alta reactividad, funciona como un fuerte agente reductor. Reduce varios tipos de compuestos químicos comunes como etileno, acetileno, peróxido de hidrógeno e iones metálicos.
El átomo de hidrógeno absorbió energía para mover sus partículas de electrones de valencia a diferentes niveles de energía. Los electrones en niveles de energía más altos son relativamente inestables y, por lo tanto, vuelven al nivel de energía más bajo para producir el espectro electromagnético o espectro H.
Isómeros de espín nuclear
Cuando el núcleo de un átomo contiene un número impar de nucleones, el núcleo tiene un espín resultante. Cuando estos dos átomos juntos forman una molécula diatómica, los núcleos pueden tener su espín paralelo o antiparalelo. Se llama isomería de espín nuclear.
- La molécula en la que los dos núcleos tienen espín paralelo se llama isómero orto.
- La molécula con espines nucleares antiparalelos se llama isómero para.
Tal isómero de espín nuclear se encuentra en H2d2T2norte2O2etc. La conversión de para-H2 a la orto-H2 la conexión es normalmente muy lenta. Se trataba de la transición prohibida entre dos estados energéticos de los diferentes municipios araña.
¿Para qué se usa el hidrógeno?
El hidrógeno y sus compuestos se utilizan ampliamente en los diversos tipos de pilas de combustible y procesos de fabricación industrial. Los usos más comunes del hidrógeno se dan a continuación,
- Se utiliza para la fabricación de amoníaco.
- Es un compuesto químico importante utilizado para la producción de ácido clorhídrico, ácido sulfúrico, ácido nítrico, alcohol metílico, etc.
- En la reacción de hidroformilación, H2 puede agregar un grupo formilo a los alquenos. El compuesto de formilo producido luego se convirtió en diferentes tipos de alcoholes. Estos alcoholes se utilizan para la fabricación de resinas de PVC y detergentes.
- El alcohol metílico preparado a partir de hidrógeno se oxida luego mediante el proceso oxo a formaldehído, que es una materia prima para la síntesis de plásticos.
- Los electrodos de hidrógeno se utilizan para determinar el pH de una solución desconocida.
- Los sopletes de hidrógeno atómico se utilizan para soldar metales de alto punto de fusión como el tántalo y el tungsteno.
- También se utiliza para la reducción de óxidos metálicos. Una reducción directa de mineral de hierro por H2 se utiliza para la fabricación de hierro.
- el liquido h2 molécula se utiliza en la propulsión de cohetes.
- En las cámaras de burbujas, el hidrógeno líquido se usa para estudiar partículas de alta energía.
- Mezcla de tipo hidrógeno-oxígeno utilizada en las celdas de combustible para la producción de energía renovable utilizando ampliamente vehículos eléctricos.
- El espectro del hidrógeno se utiliza para analizar varios tipos de propiedades físicas o químicas.
Uso de deuterio
- El deuterio es un isótopo común del hidrógeno que se utiliza principalmente para la producción de agua pesada.
- El agua pesada obtenida del deuterio se utiliza como moderador y refrigerante en los reactores nucleares.
- El óxido de deuterio es la principal fuente de compuestos de deuterio.
- El deuterio y sus compuestos se utilizan ampliamente para estudiar los mecanismos de reacción.
Uso de tritio
- El tritio se usa ampliamente como elemento trazador debido a su radiactividad.
- Tritium hace un amplio uso de los estudios hidrológicos en el momento de las aguas subterráneas en el medio ambiente terrestre
- También se utiliza para estudiar la absorción de metales cristalinos y aleaciones multifase en autorradiografía.
- El isótopo de hidrógeno tritio se utiliza para estudiar el mecanismo de reacción, la cinética de reacción y la catálisis homogénea.