¿Qué es el molibdeno?
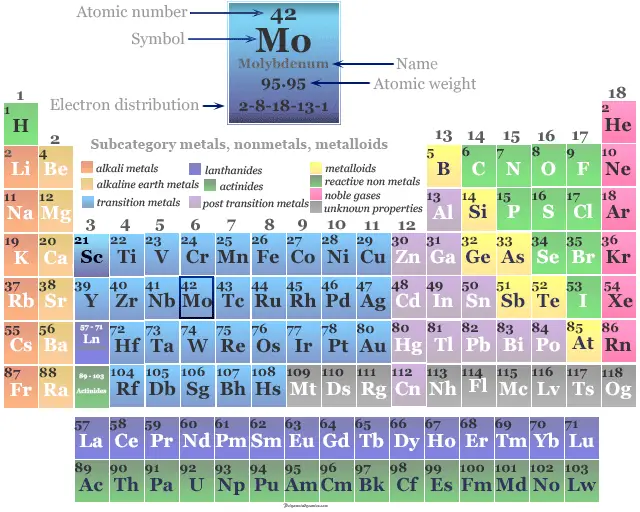
molibdeno es un elemento químico o metal de transición fuerte y plateado del grupo 6 (VIB) de la tabla periódica con el símbolo Mo y número atómico 42. Se utiliza principalmente para fabricar acero inoxidable y acero aleado para herramientas de alta velocidad.

El nombre molibdeno se deriva de la palabra griega molybdos, que significa plomo. Es el elemento de la segunda serie de transición en el que todos los electrones d participan en el enlace metálico. Es un elemento del bloque d, colocado con cromo y tungsteno en la tabla periódica.
Lectura relacionada: ¿Qué es el circonio? Símbolo, Propiedades, Conexiones, Uso
¿Qué es el circonio? Símbolo, Propiedades, Conexiones, Uso¿Quién descubrió el molibdeno?
La molibdenita negra blanda (MoS2) es el principal mineral de molibdeno utilizado anteriormente para escribir. Era comparable a la del mineral de plomo (galena o PbS) y el grafito.
El mineral fue estudiado por primera vez en 1754 por el mineralogista sueco A. Cronstedt. En 1778, el químico sueco Carl Wilhelm Scheele notó que no era ni galena ni grafito. Preparó el óxido de molibdeno metálico.
El metal puro fue preparado por Berzelius en 1817 reduciendo el óxido con hidrógeno. El nombre del metal se deriva de la palabra griega molybdos, que significa plomo.
Lectura relacionada: Metales de transición: elementos, definición, lista, propiedades
Metales de transición: elementos, definición, lista, propiedadesPropiedades del molibdeno
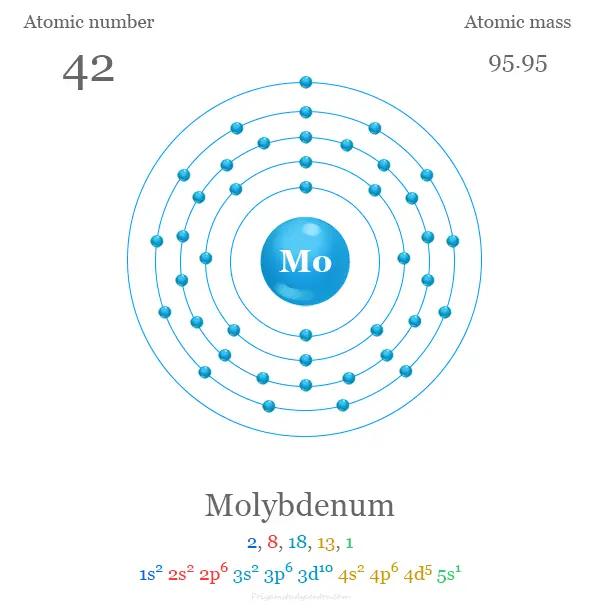
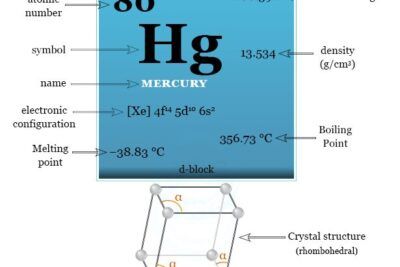
El número atómico de Mo es 42 y la configuración electrónica de la capa de valencia [Kr] 4d5 5s1. La forma metálica es típicamente una red cristalina cúbica centrada en el cuerpo metálico. Es duro y relativamente poco reactivo debido a la capa superficial protectora de óxido.
Lectura relacionada: Elementos de tierras raras: metales, definición, propiedades, usos
Elementos de tierras raras: metales, definición, propiedades, usosEl número de oxidación o estado más común del molibdeno metálico es +6 (VI). Los estados de oxidación V y IV también son estables. Fuertes propiedades reductoras del molibdeno metálico no logradas antes de los estados III y II.
| Propiedades del Molibdeno |
|||
| número atómico | 42 | ||
| electrón por escala | 2, 8, 18, 13, 1 | ||
| Configuración electrónica | [Kr] 4d5 5s1 | ||
| Bloquear | bloque d | ||
| Período de tiempo | periodo 5 | ||
| Grupo | grupo 6 | ||
| Peso atomico | 95.94 | ||
| Punto de fusion | 2896K (2623°C, 4753°F) | ||
| Punto de ebullición | 4912K (4639°C, 8382°F) | ||
| estructura cristalina | |||
| Espesor | 10,28 g/cm3 | ||
| Capacidad calorífica molar | 24,06 J mol−1k−1 | ||
| Resistencia eléctrica | 53,40 nΩ·m | ||
| Radio atómico | 139 horas | ||
| Radio covalente | 154±5 pm | ||
| Propiedades químicas | |||
| Número de oxidación común | +6 | ||
| Electronegatividad | Escala de Pauling: 2.16" | ||
| Energía de ionización (kJ/mol) | 1º | 2do | 3ro |
| 684.3 | 1560 | 2618 | |
Fuente de molibdeno
Los metales molibdeno y tungsteno se encuentran en cantidades muy pequeñas en la atmósfera terrestre. Es el 54º elemento más abundante en la corteza terrestre con una incidencia de 1,5 partes por millón.
El principal mineral de Mo es la molibdenita (MoS2). Se encuentra principalmente en Colorado (EE.UU.), Canadá y Chile. Otros minerales del metal Mo son la wulfenita (PbMoO4) y molibdita (MoO3).
Alimentos que contienen molibdeno
También se encuentra en cereales, verduras y productos animales. Las fuentes más ricas de molibdeno son las legumbres, los cereales integrales, los frutos secos, la leche y el hígado de res. Es el único elemento o metal de la segunda serie de transición que tiene funciones biológicas naturales.
La leche, el queso y los huevos son las principales fuentes de molibdeno metálico para niños y adolescentes. Nuestra agua potable diaria también contiene algo de Mo metal.
Isótopos de molibdeno
El molibdeno tiene 35 isótopos conocidos con masas atómicas de 83 a 113. Tiene siete isótopos naturales con masas atómicas 92, 94, 95, 96, 97, 98 y 100.
Los isótopos radiactivos del metal se obtienen mediante diferentes tipos de reacciones nucleares. 93Mo es el radioisótopo más estable del metal con una vida media de 4.000 años.
Proceso de producción
- La molibdenita se concentró por flotación de espuma y se tostó a MoO3.
- Primero se reduce a MoO2 calentando con hidrógeno a 500 °C.
- En el segundo paso, MoO2 se reduce con hidrógeno a 1100°C para obtener el metal.
- El molibdeno metálico puro se obtiene mediante la reducción con hidrógeno del molibdato de amonio. Reducción de carbono de MoO3 produce principalmente carburos.
El ferromolibdeno se prepara reduciendo molibdenita con hierro y coque en un horno eléctrico. También se prepara reduciendo una mezcla de óxidos de Mo y Fe con aluminio (reacción de la termita).
El metal tiene un punto de fusión muy alto y se obtiene inicialmente en forma de polvo de molibdeno. Se convierte a estado sólido por compresión bajo hidrógeno a altas temperaturas.
Ingredientes químicos
La química de los metales de transición molibdeno y tungsteno es muy similar. Los metales son ligeramente atacados por ácidos y bases débiles. Ambos se disuelven en una mezcla de ácido nítrico y fluoruro de hidrógeno y en álcalis fundidos. Los compuestos de óxido son ácidos, pero las sales derivadas de ácidos son polianiones complejos.
Los estados de oxidación habituales y estables de estos metales son +6 (VI). Los estados de oxidación V y IV también son estables. Las fuertes propiedades reductoras del molibdeno no se observan antes de los estados III y II. En el estado VI, el metal forma óxidos, oxoácidos, hexafluoruros y hexacloruros.
Óxido de molibdeno
El molibdeno forma óxido hexavalente como MoO3. Se precipita a partir de molibdatos alcalinos por adición de ácidos. El derribado H2mugir4 puede encenderse para formar óxidos. El óxido también se puede preparar por ignición de metal en aire u oxígeno.
Todos los óxidos son ácidos y se disuelven en álcali para dar molibdatos. El óxido CrO3 es altamente oxidante en la naturaleza. Los óxidos como MoO2 y la Primera Guerra Mundial2 no tienen propiedades oxidantes.
El óxido inferior MoO2 se obtuvo por reducción de trióxido con hidrógeno. La naturaleza ácida del óxido disminuye al disminuir el estado de oxidación.
haluros de molibdeno
Con el alto número de oxidación, se espera que los haluros de molibdeno sean de naturaleza covalente. Por lo tanto, MdF6 es un punto de ebullición bajo, no electrolito, diamagnético y extremadamente disuelto para la hidrólisis. MoCl5 es un monómero en estado de vapor pero un dímero con puente en estado cristalino. Los haluros inferiores son estructuras muy complicadas.
Los haluros superiores se obtienen por halogenación directa del metal. Los haluros inferiores se obtienen mediante la reducción de haluros superiores con metal o hidrógeno a temperatura y presión optimizadas.
complejos de molibdeno
Forma MO monomérico4−2 aniones en medio alcalino. En la acidificación, los aniones se polimerizan para dar poliácidos. Estos dan lugar a un complejo como el dioxomolibdeno (VI).
Los complejos pentavalentes suelen ser del tipo oxo-molibdeno o di-μ-oxodimolibdeno. Algunos ejemplos comunes de complejos de Mo(IV) son: [MoCl5O]−2, [Mo(acac)2ClO]−2etc. Los complejos tetravalentes son de tipo oxo y noxo.
En un estado de oxidación más bajo, el molibdeno forma Mo6X12 compuestos de clúster (donde X = cloro, bromo y yodo). En este tipo de compuesto, seis átomos de Mo forman compuestos en forma de racimo como (MoX8)+4X4. El complejo de ciano se puede preparar reduciendo el complejo de Mo(IV). Tiene una estructura bipiramidal pentagonal.
uso de molibdeno
- El principal consumo de molibdeno se utiliza en la fabricación de acero inoxidable y otros aceros utilizados en herramientas de alta velocidad. El óxido MoO3 y ferro molibdeno se utilizan directamente para esto.
- El molibdeno aumenta la resistencia mecánica, la conductividad eléctrica y la resistencia a la corrosión del acero. Por lo tanto, el acero Ni-Mo se usa para fabricar cañones de armas y ejes de hélice. El acero Cr-Mo se utiliza para fabricar aviones.
- El molibdeno metálico puro se utiliza para tratar el petróleo crudo con gas hidrógeno. El metal y el hidrógeno convierten los compuestos orgánicos que contienen azufre en H2s.
- El molibdeno metálico se utiliza como catalizador químico. El MoS compuesto2 tiene una red cristalina baja y se usa para hacer lubricantes de alta temperatura.
Función biológica del molibdeno
Es el único elemento o metal de la segunda serie de transición que tiene funciones biológicas naturales. Se sabe que más de treinta microorganismos, plantas y animales contienen el metal.
Las nitrogenasas de enzimas de fijación de nitrógeno contienen un grupo polimetálico característico con el cofactor hierro-molibdeno. Otras enzimas, como la oxidasa, la reductasa y la deshidrogenasa, tienen diferentes tipos de cofactores de molibdeno metálico.