
¿Qué es el Holmio?
Holmio es un elemento químico o metal de tierras raras en la tabla periódica con el símbolo Ho y número atómico 67. Al igual que otros lantánidos, es el metal reactivo y más blando que puede formar una capa de óxido amarillento cuando se expone al aire o al oxígeno.

El holmio se utiliza en láseres de estado sólido para equipos de microondas y tecnología de fibra óptica. También se usa para hacer un concentrador de flujo magnético para hacer imanes artificiales y vidrios usados en espectrofotómetros ópticos para calibración.
Lectura relacionada: Disprosio - Elemento, Símbolo, Uso, Hechos
Disprosio - Elemento, Símbolo, Uso, HechosFue descubierto en 1878 por el químico sueco Per Theodor Cleve y de forma independiente por Jacques-Louis Soret y Marc Delafontaine. El nombre del elemento proviene de la palabra latina Holmia, que significa la ciudad de Estocolmo.
¿Dónde se encuentra el holmio?
El holmio se encuentra en la naturaleza junto con otros metales de tierras raras. La abundancia del metal es comparable a la del tungsteno. Como muchos otros lantánidos, se encuentra en los minerales monacita y gadolinita y se extrae o separa comercialmente mediante técnicas de cromatografía de intercambio iónico.
La mayor parte de la producción mundial de holmio proviene de las regiones mineras de China, EE. UU., Brasil, India, Sri Lanka y Australia.
Lectura relacionada: Francio, Símbolo, Propiedades, Hechos, Uso
Francio, Símbolo, Propiedades, Hechos, Usoisótopos
El holmio natural tiene un isótopo estable con masa atómica 165. También contiene 35 isótopos radiactivos sintéticos que pueden sintetizarse mediante diversas reacciones nucleares artificiales. La mayoría de estos isótopos radiactivos tienen una vida media de menos de 3 horas.
el metaestable 166m1Ho (vida media de unos 1200 años) se ha utilizado en física nuclear para calibrar espectrómetros de rayos gamma.
Propiedades
El holmio es un metal suave, maleable y brillante con alta conductividad eléctrica. Es un metal de color plateado que pertenece a la serie de los lantánidos de la tabla periódica.
Lectura relacionada: Rubidio - Metal, Símbolo, Propiedades, Uso
Rubidio - Metal, Símbolo, Propiedades, Uso| holmio | |||
| Símbolo | Ho | ||
| Descubrimiento | Por Teodor Cleve e independientemente por Marc Delafontaine y Louis Soret en 1878 | ||
| Nombre derivado de | El nombre latino de Estocolmo significa Holmia. | ||
| isótopo común | 67Ho165 | ||
| Condición de oxidación | +3 | ||
| número CAS | 7440-60-0 | ||
| Propiedades periódicas | |||
| número atómico | 67 | ||
| Masa atómica relativa | 164,930 | ||
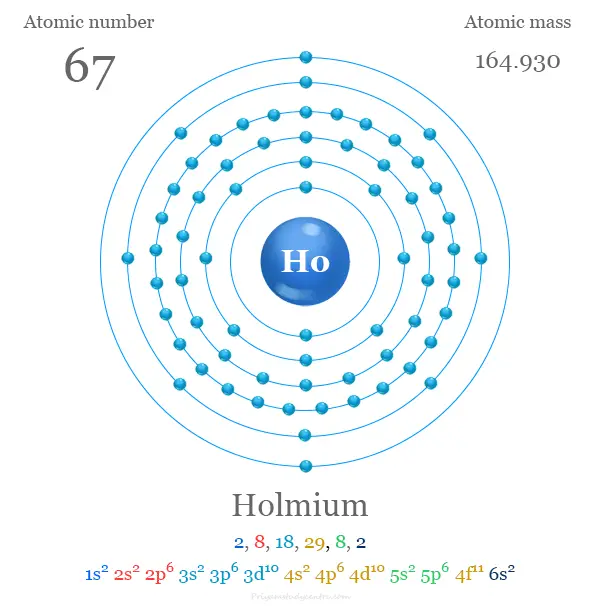
| electrón por celda | 2, 8, 18, 29, 8, 2 | ||
| Configuración electrónica | [Xe] 4f11 6s2 | ||
| Bloquear | bloque f | ||
| Grupo | lantánidos | ||
| Período de tiempo | 6 | ||
| Características físicas | |||
| Condición a 20 °C | firma | ||
| Punto de fusion | 1472 °C, 1745 K | ||
| Punto de ebullición | 2700 °C, 2973 K | ||
| Capacidad calorífica molar | 27,15 J mol−1 k1 | ||
| estructura cristalina | empaquetado cerrado hexagonal (hcp) | ||
| Espesor | 8,80 g/cm23 | ||
| Calor de fusión | 17 kJ mol−1 | ||
| Calor de evaporación | 251 kJ mol−1 | ||
| Propiedades atómicas | |||
| Radio atómico (sin consolidar) | 2:30 a. m. | ||
| Radio covalente | 1.79 | ||
| electronegatividad | 1,23 (escala de Pauling) | ||
| Afinidad electronica | Desconocido | ||
| Energía de ionización (kJ/mol) | 1º | 2do | 3ro |
| 580.99 | 1138.50 | 2203.73 | |
Configuración electrónica de holmio
Los 67 electrones de holmio se dividen en diferentes niveles de energía u orbitales para dar la siguiente configuración electrónica,
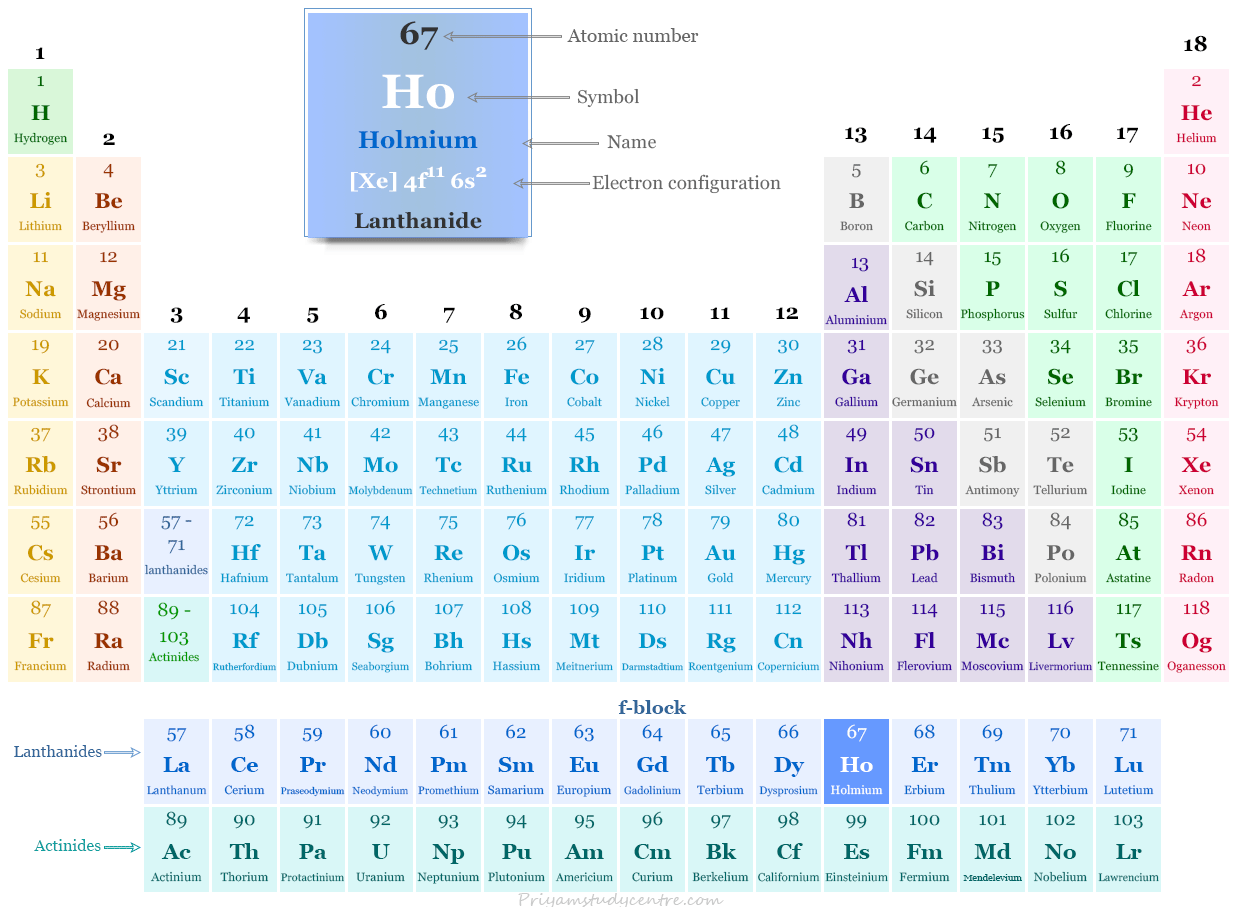
Holmio en la tabla periódica
El holmio, un metal de tierras raras, se coloca en el bloque f de la tabla periódica. Es el lantánido que se encuentra entre el disprosio y el erbio.
Propiedades químicas
El holmio es un metal de tierras raras altamente reactivo y electropositivo que es estable en aire seco a temperaturas normales, pero se empaña rápidamente en atmósferas húmedas. Se quema en el aire para formar óxido amarillo Ho. Dar forma2O3.
4 horas + 3 horas2 → 2 Cómo2O3
Está muy por encima del hidrógeno en la serie electroquímica. Por lo tanto, reacciona lentamente con agua fría y rápidamente con agua caliente para liberar gas hidrógeno.
2 horas + 6 horas2O → 2Ho(OH)3 + 3 horas2
Las reacciones con ácidos son más violentas, pero el metal no se disuelve en álcalis. Se disuelve fácilmente en ácido sulfúrico diluido para formar soluciones que contienen iones amarillos de holmio (III).
2 horas + 3 horas2ASI QUE4 → 2 Cómo3+ + 3 SO4−2 + 3 horas2
El holmio es normalmente de trihaluros con halógenos como flúor, cloro, bromo y yodo.
2Ho + 3X2 (X = F, Cl, Br, I) → 2 HoX3
Datos sobre el holmio
- No se encuentra en la naturaleza en elementos libres debido a su alta reactividad.
- Es uno de los raros lantánidos que es 20 veces más abundante que la plata.
- Es el sexto lantánido más volátil después del iterbio, europio, samario, tulio y disprosio.
- Como muchos lantánidos, el holmio formó compuestos químicos en el estado o número de oxidación +3, pero en el estado +2, el fluoruro (HoF3) y cloruro (HoCl3) conexiones.
- Se combina con itrio para formar un compuesto altamente magnético.
- No juega un papel biológico en los humanos, pero las sales de holmio pueden simular el metabolismo humano.
¿Para qué se usa el holmio?
- El holmio se alea con otros metales para hacer los imanes artificiales más fuertes.
- Se utiliza para controlar reacciones en cadena en reactores nucleares porque tiene altas propiedades de absorción de neutrones.
- El granate de hierro itrio dopado con holmio (YIG) y el fluoruro de litio itrio (YLF) se han utilizado para fabricar láseres de estado sólido. Estos láseres se utilizan ampliamente en tecnología de microondas y fibra óptica.
- El vidrio de óxido de holmio tiene picos de absorción óptica agudos con un rango de longitud de onda de 200-900 nm. Por lo tanto, se puede utilizar en espectrofotómetros ópticos para calibración.
- El isótopo radiactivo metaestable de larga vida de holmio (166m1Ho) se utiliza para la calibración de espectrómetros de rayos gamma.












