Níquel metálico
Níquel es un elemento químico, plateado, maleable, dúctil, metal de transición ferromagnético del grupo 10 de la tabla periódica con número atómico 28 y símbolo Ni. Se utiliza para fabricar aleaciones con hierro y otros metales no ferrosos como la plata y el cromo.
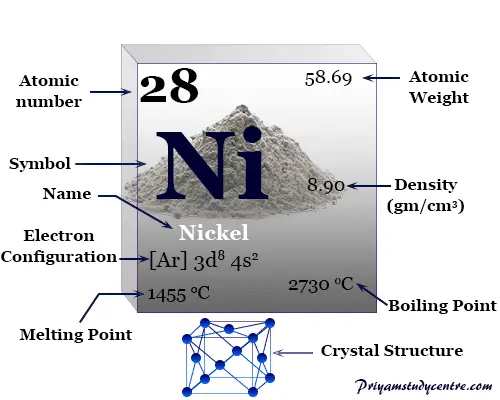
La configuración electrónica de la capa de valencia del níquel. [Ar] 3d8 4s2 con orbital d incompleto. Por lo tanto, suele mostrar un número o estado de oxidación +2.
Lectura relacionada: manganeso, Símbolo, Propiedades, Conexiones, Uso
manganeso, Símbolo, Propiedades, Conexiones, UsoEl metal compacto es bastante resistente al aire o al agua, pero el níquel finamente dividido es altamente reactivo y pirofórico. Es atacado lentamente por los ácidos clorhídrico y sulfúrico diluidos, pero se disuelve fácilmente en agua regia y nítrico diluidos.
historia del níquel
El nombre del níquel metálico se deriva de la palabra alemana espíritu del diablo.
En el siglo XVII, un mineral parecía cuprita, pero no se podía fundir para obtener cobre. Los metalúrgicos decidieron que el mineral estaba dominado por el espíritu maligno del diablo de cobre de montaña o níquel Kupfer.
Lectura relacionada: Cromo, Hechos, Propiedades, Conexiones, Uso
Cromo, Hechos, Propiedades, Conexiones, UsoLa confusión sobre el mineral continúa hasta 1751. En 1751, Axel Fredrik Cronstedt extrae cobre del diablo de cobre o mineral de níquel Kupfer en Suecia.
Algún tiempo después, los científicos creyeron que el Ni era una mezcla de cobalto, hierro, arsénico y cobre. Las dudas fueron finalmente resueltas por el científico T Bergmann en 1775.
Propiedades del níquel
El níquel de celosía de cristal cúbico centrado en la cara es un metal plateado duro. Es altamente maleable y maleable y se enrolla o pule fácilmente.
Lectura relacionada: Yodo, Símbolo, Propiedades, Hechos, Conexiones, Uso
Yodo, Símbolo, Propiedades, Hechos, Conexiones, UsoLas propiedades ferromagnéticas y el punto de Courie del cobalto (375 °C) son menores que las del cobalto y el hierro. El metal compacto es bastante resistente al aire y al agua, pero un fuerte calentamiento en el aire produce poco óxido.
Algunas propiedades físicas y atómicas comunes del níquel se dan debajo de la tabla,
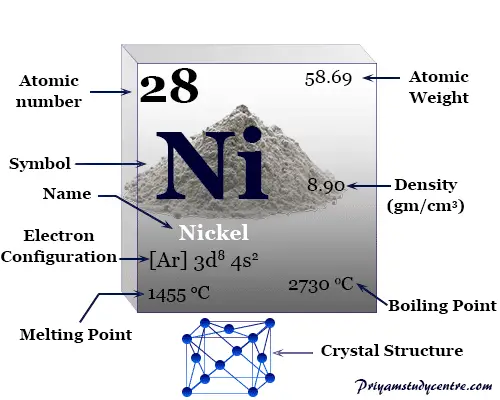
| Níquel | |||
| Símbolo | Ni | ||
| Descubrimiento | Axel Fredrik Cronstedt en 1751 | ||
| Nombre derivado de | La palabra alemana espíritu del diablo | ||
| isótopo común | 28Ni58 | ||
| Estados de oxidación | +3, +20 | ||
| número CAS | 7440-02-0 | ||
| Propiedades periódicas | |||
| número atómico | 28 | ||
| Masa atómica relativa | 58,693 | ||
| electrón por celda | 2, 8, 16, 2 | ||
| Configuración electrónica | [Ar] 3d8 4s2 | ||
| Bloquear | bloque d | ||
| Grupo | 10 | ||
| Período de tiempo | 4 | ||
| Características físicas | |||
| Condición a 20 °C | firma | ||
| Punto de fusion | 1455 °C, 2651 °F, 1728 K | ||
| Punto de ebullición | 2913°C, 5275°F, 3186K | ||
| Capacidad calorífica molar | 26,07 J mol−1 k1 | ||
| estructura cristalina | cúbico centrado en las caras (fcc) | ||
| Espesor | 8,90 g/cm23 | ||
| Resistencia eléctrica | 69,3 nΩm | ||
| Propiedades atómicas | |||
| Radio atómico (sin consolidar) | 1.97 | ||
| Radio covalente | 1.17 | ||
| Electronegatividad | 1,91 (escala de Pauling) | ||
| Afinidad electronica | 111,54 kJ mol−1 | ||
| Energía de ionización (kJ/mol) | 1º | 2do | 3ro |
| 737.13 | 1753.03 | 3395.32 | |
Níquel en la tabla periódica
El níquel, un metal de transición, se coloca en el período 4 y el grupo 10 de la tabla periódica con otros miembros del grupo, el paladio y el platino.
¿Dónde se encuentra el níquel?
Es el vigésimo segundo elemento que se encuentra en la corteza terrestre y el séptimo metal más abundante entre los elementos de transición. Por lo general, se encuentra en combinación con azufre, hierro y arsénico en la niquelina, similar a un mineral.
La limonita que contiene níquel, NiO(OH) o FeO(OH) y garnierita (Ni, Mg)6Si4O10(OH)8 son los principales minerales del metal.
Indonesia y Australia tienen las mayores reservas de metales. La garnierita se encuentra en Nueva Caledonia, Cuba, Brasil y Queensland. El principal yacimiento individual de níquel se encuentra en países como Sudbury, Canadá, Rusia y Sudáfrica.
Isótopos de níquel
Tiene cinco isótopos naturales como: 58no, 60no, 61no, 62Ni, y 64Ni con diferentes isótopos radiactivos (la masa atómica oscila entre 48 y 78).
producción de níquel
El níquel se produce principalmente a partir de mineral de sulfuro que contiene aproximadamente un 3 por ciento de Ni, un 1,5 por ciento de cobre y metales preciosos como el oro, la plata y el platino. Los principales pasos para la extracción de metales,
- Mineral de sulfuro concentrado de flotación magnética o selectiva.
- El mineral de sulfuro concentrado se somete a una serie de rejillas y se funde con la adición de sílice y piedra caliza.
- El sulfuro rico en Ni y Cu se separa en fase sólida que luego se extrae mediante el proceso Mond o electrolíticamente.
Proceso de boca para refinar
- En el proceso de refinación de boca de níquel, el sulfuro de Ni-Cu se tuesta para oxidar a sus óxidos.
- Los óxidos se lixivian con ácido sulfúrico diluido caliente, la mayor parte del óxido de cobre se disuelve como CuSO4.
- El óxido se reduce ahora con hidrógeno en gas de agua a aproximadamente 300 a 350°C.
- El metal impuro se convierte ahora en tetracarbonilo volátil por la acción del monóxido de carbono a una presión atmosférica de unos 50°C.
- La forma pura de níquel se obtiene al descomponer el tetracarbonilo metálico.
Refinación electrolítica
En el proceso de refinación electrolítica, el mate Ni-Cu se tuesta en una rejilla de varios hogares para formar sus respectivos óxidos. La mayor parte del óxido de cobre se lixivia con ácido sulfúrico diluido caliente.
El residuo se reduce aún más con coque que contiene 65 por ciento de Ni, 30 por ciento de cobre y de 3 a 8 por ciento de residuos de azufre y hierro.
La electrólisis se realiza con NiSO4 solución con electrodo de Ni o cátodos sobre los que se deposita el metal puro.
Datos interesantes sobre el níquel
- Es atacado lentamente por los ácidos clorhídrico y sulfúrico diluidos, pero se disuelve fácilmente en ácido nítrico.
- En la práctica, no es atacado por los álcalis cáusticos.
- Reacciona lentamente con el flúor a temperaturas normales. El Ni calentado se incendia en cloro o bromo.
- Tiene una propiedad ferromagnética menor que la del hierro o el cobalto.
Ingredientes químicos
En el estado +2, el níquel forma una amplia variedad de compuestos simples como óxido (NiO), hidróxido (NiOH), sulfuro de haluro (NiS), carbonato (NiCO3), cianuro (NiCN) y compuestos complejos.
Algunos compuestos comunes de níquel se discuten a continuación,
óxido de níquel
El NiO sólido verde es el óxido común de níquel. El NiO se forma por descomposición térmica del hidróxido, carbonato, oxalato o nitrato.
Tiene una estructura sólida cristalina cúbica que es fácilmente soluble en agua.
Hidróxido
El hidróxido de níquel de color verde tiene la fórmula química Ni(OH)2. El precipitado de gel verde de Ni(OH)2 se forma por la adición de una solución de hidróxido de metal alcalino a Ni(II) acuoso.
El precipitado se vuelve cristalino en reposo prolongado. Ni(OH)2 se disuelve fácilmente en ácidos y amoníaco para formar compuestos complejos solubles.
haluros
Es el único metal de los primeros elementos de transición que forma haluros en estado de oxidación +2. Los cuatro haluros anhidros como NiX2 Son conocidos.
Fluoruro de níquel (NiF2) es poco soluble en agua, otros haluros son bastante solubles en agua.
Uso de níquel
El metal se utiliza para fabricar celdas eléctricas como las celdas alcalinas de Fe-Ni y Cd-Ni y electrodos de difusión de gas para celdas de combustible alcalinas.
¿Qué es una aleación de níquel?
El metal se utiliza principalmente en forma de aleaciones como el metal Monel, alpaca, nicromo, álnico con hierro y otros metales no ferrosos.
Una pequeña cantidad de Ni aumenta la calidad del hierro fundido. Por ejemplo, 0,25 a 0,45 por ciento de Ni en el acero aumenta las propiedades mecánicas y las propiedades de resistencia a la corrosión.
El 68 por ciento del níquel de la producción mundial se utiliza para fabricar acero inoxidable. El metal se utiliza en muchos productos industriales y de consumo, como acero inoxidable, imanes, baterías recargables, placas eléctricas, etc.
La aleación, alnico, se utiliza para fabricar imanes permanentes como los imanes de herradura.
Usos de los catalizadores de níquel:
El catalizador químico de níquel se utiliza para la hidrogenación de aceites e hidrocarburos en química orgánica.
El catalizador químico habitual para este propósito es Raney Nickel. Es una forma muy activa del metal que se prepara disolviendo el aluminio de la aleación NiAl.3 con álcali
Papel del níquel en el sistema biológico
El uso biológico natural del níquel no se estableció hasta 1975 con el descubrimiento del metal en la enzima ureasa del frijol jack.
La enzima está presente en varias plantas, eubacterias, arqueobacterias y hongos. La enzima contiene un estado de oxidación inusual como +2 con una unidad de reacción redox inactiva que contiene Ni octaédrico que actúa como un ácido de Lewis.
Los centros de níquel activos redox están presentes en otras enzimas como la hidrogenasa, la CO deshidrogenasa y la metil S-coenzima M reductasa, que se encuentran principalmente en las bacterias.