¿Qué es el radio?
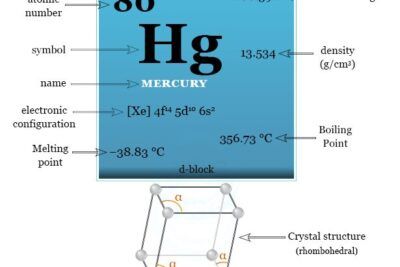
Radio es un elemento químico o metal radiactivo que se encuentra en el grupo 2 de la tabla periódica con el símbolo real academia de bellas artes y el número atómico 88. El radio puro es un metal alcalinotérreo de color blanco plateado que reacciona fácilmente con el nitrógeno para formar una capa negra de nitruro de radio.

Los cuatro isótopos de radio son radiactivos por naturaleza. Ra no ocurre naturalmente en cantidades significativas. Ocurre en pequeñas cantidades en la pechblenda. Ra es un producto de desintegración radiactiva de las cadenas de desintegración del uranio y el torio. El isótopo más estable, Ra-226, tiene una vida media de 16 años.
Lectura relacionada: Cesio - Elemento, Símbolo, Uso
Cesio - Elemento, Símbolo, UsoEl cloruro de radio compuesto fue descubierto en 1898 por Marie y Pierre Curie a partir de uraninita mineral de uranio. En 1911, Marie Curie y André-Louis Debierne extrajeron la forma metálica del radio mediante la electrólisis del cloruro de radio.
¿Dónde se encuentra el radio?
Se encuentran trazas de radio en nuestros entornos naturales, como rocas, suelo, agua, plantas y animales. La presencia de Ra en la corteza y el agua de mar es muy pequeña. Un kilogramo de corteza terrestre contiene solo 900 picogramos de Ra y un litro de agua de mar contiene solo alrededor de 89 femtogramos de Ra.
El radio se recupera en pequeñas cantidades como subproducto del refinado de uranio. Se puede producir en todo el mundo en menos de 100 años. Se deben usar casi 10 toneladas de mineral para producir 1 mg de Ra.
Lectura relacionada: Arsénico - Envenenamiento, Elemento, Uso, Propiedades
Arsénico - Envenenamiento, Elemento, Uso, Propiedadesisótopos
El radio tiene 33 isótopos radiactivos conocidos con números de masa de 202 a 234. Cuatro de estos isótopos se encuentran naturalmente en las cadenas de desintegración del torio-232, el uranio-235 y el uranio-238. La vida media de estos isótopos,
- 223real academia de bellas artes: vida media 11,4 días
- 224real academia de bellas artes: vida media 3,64 días
- 226real academia de bellas artes: vida media 1600 años
- 228real academia de bellas artes: vida media 5,75 años
El isótopo más abundante de Ra es 226Ra con una vida media de 1600 años. Ocurre en la cadena de descomposición de 238tú.
¿Cómo se extrae el radio?
Con un cambio menor, el proceso de extracción de radio de la pechblenda sigue siendo el mismo que el de Marie y Pierre Curie.
Lectura relacionada: Plomo, propiedades, símbolo, extracción, hechos, uso
Plomo, propiedades, símbolo, extracción, hechos, uso- La pechblenda se muele finamente y se tuesta a más de 600 °C.
- Se digiere con ácido sulfúrico 1:1 durante seis horas. El uranio, el hierro, el manganeso y el cobre entran en la solución. El radio permanece insoluble como sulfato con BaSO4PbSO4sílice, etc
- El residuo se lixivia con una solución de tiosulfato de sodio para eliminar la plata y se digiere con hidróxido de sodio al 10 % para eliminar el plomo y la sílice.
- Luego, los sulfatos se convierten en carbonato por reacción con Na2CO3. El carbonato se disuelve en ácido clorhídrico para dar cloruros. Estos dos procesos se repiten varias veces.
- Finalmente, el carbonato se disuelve en HBr para dar RaBr. dar2 y BaBr2.
- RaBr menos soluble2 se puede separar de BaBr2 por cristalización fraccionada. Puede ser necesaria una cristalización de 20 a 200 para obtener RaBr lo suficientemente puro. para obtener2.
- El producto se enciende a 600°C y se sella con capilares de vidrio. Por lo general, viene en esta forma.
- El radio metálico se puede obtener por electrólisis de RaBr2 o RaCl2 solución.
Propiedades
El radio es un metal radiactivo de color blanco plateado, brillante y suave que contiene dos electrones de valencia para la unión de metales. Debido a la presencia de dos electrones de valencia para la unión de metales, los metales alcalinotérreos son relativamente más duros que los metales alcalinos.
| Radio | ||
| Símbolo | licenciado en Letras | |
| Descubrimiento | Pierre y Marie Curie en 1898 | |
| Nombre derivado de | La palabra latina rayo significa rayo. | |
| isótopos comunes | 56licenciado en Letras226 | |
| número de oxidación o estado | +2 | |
| número CAS | 7440-14-4 | |
| Propiedades periódicas | ||
| número atómico | 88 | |
| Masa atómica relativa | [226] | |
| electrón por celda | 2, 8, 18, 32, 18, 8, 2 | |
| Configuración electrónica | [Rn] 7s2 | |
| Bloquear | bloque s | |
| Grupo | 2 | |
| Período de tiempo | 7 | |
| Características físicas | ||
| Condición a 20 °C | firma | |
| Punto de fusion | 696°C, 969K | |
| Punto de ebullición | 1500 °C, 1773 K | |
| ocurrencia natural | de la desintegración radiactiva | |
| estructura cristalina | cúbico centrado en las caras (fcc) | |
| Espesor | 5 g/cm23 | |
| Resistencia eléctrica | 1 µm | |
| Propiedades atómicas | ||
| Radio atómico (sin consolidar) | 2.83 | |
| Radio covalente | 2.11 | |
| Electronegatividad | 0,90 (escala de Pauling) | |
| Afinidad electronica | 9,65 kJ mol−1 | |
| Energía de ionización (kJ/mol) | 1º | 2do |
| 509.29 | 979.05 | |
Radio en la tabla periódica
Se coloca en el grupo 2 y el período 7 de la tabla periódica. El radio es un metal alcalinotérreo adyacente al berilio, magnesio, calcio, estroncio y bario.
Datos sobre el radio
- Es más duro que los metales alcalinos debido a la disponibilidad de dos electrones para la unión de metales.
- Los puntos de fusión de los metales alcalinotérreos son significativamente más altos por la misma razón.
- Como otros metales alcalinotérreos, es un metal altamente reactivo y siempre exhibe un estado de oxidación de +2.
- Forma Ra incoloro2+ catión en una solución acuosa de naturaleza altamente básica.
- El alto valor de la tercera energía de ionización es de esperarse de la configuración de capa cerrada de Ra+2 ion. Explica el límite superior del estado de oxidación +2 de los elementos.
- La mayoría de los compuestos de radio son de naturaleza iónica.
- El potencial de electrodo estándar para la semirreacción es ligeramente más bajo que el bario metálico anterior. En general, aumentó el potencial de reducción de los elementos del grupo 2 en el grupo.
uso de radio
Actualmente, el uso de radio se puede reducir debido a su alta radiactividad.
- La forma de radio, como RaCl o RaBr, se usa en medicina para producir gas radón. Anteriormente se usaba para matar las células cancerosas en los huesos. Actualmente está siendo reemplazado por rayos gamma más seguros. 60También porque 60Co es más barato y está disponible en grandes cantidades.
- Solía usarse en pintura luminiscente para relojes, paneles nucleares, interruptores de aviones, relojes, etc.
- A principios del siglo XIX, se usaba como aditivo en pasta de dientes, cremas para el cabello y productos alimenticios. El uso de radio en dichos artículos ahora está estrictamente prohibido debido a sus graves efectos sobre la salud y su naturaleza radiactiva.
- El radio actúa como fuente de neutrones para reactores nucleares cuando se mezcla con berilio.
- Se utiliza en los campos de la investigación física atómica, molecular y óptica.
Efectos en la salud
Es altamente radiotóxico y cancerígeno por naturaleza. Es más radiactivo que el uranio metálico. La inhalación de radio puede aumentar el riesgo de cáncer, especialmente cáncer de pulmón y de huesos, y puede causar varios problemas de salud graves. Los niveles más altos de radio pueden causar anemia y cáncer de huesos, lo que reduce el crecimiento de nuestros huesos.
La exposición a Ra de fuentes internas o externas puede causar cáncer y otros problemas de salud. El radio y el radón emiten rayos alfa y gamma en su desintegración radiactiva que matan o alteran las células de nuestro cuerpo.