
¿Qué es el rodio?
Metal rodio es uno de los elementos más raros del grupo 9 de la tabla periódica con el símbolo Rh y número atómico 45. Es un metal de transición de color blanco plateado, duro y resistente a la corrosión que se encuentra en los minerales de platino o níquel. Rodio es un metal de alta calidad que se utiliza para enchapar joyas de oro y plata para mejorar su apariencia.

Los metales paladio y rodio fueron descubiertos en el mismo año (1803) por el físico y químico inglés Sir William Hyde Wollaston. Después de este descubrimiento, el paladio se considera un metal exigente en el mercado mundial, pero el rodio es menos conocido. En ese momento, no se usaba mucho debido a su rareza en abundancia, dificultad para moldearse y alto punto de fusión.
Lectura relacionada: Lutecio, Uso, Símbolo, Hechos, Precio
Lutecio, Uso, Símbolo, Hechos, PrecioPero con el paso de los años, se utilizó para la galvanoplastia y el recubrimiento resistente a la corrosión en joyería. El catalizador se descubrió en 1976. Después de este descubrimiento, la demanda y el precio del rodio metálico aumentaron significativamente.
Se utiliza en el convertidor catalítico de cada coche nuevo. Por lo tanto, el valor del rodio depende en gran medida de la demanda de la industria automotriz. El precio del metal también podría verse afectado por la oferta del principal exportador Sudáfrica, seguida de Rusia.
¿Dónde se encuentra el rodio?
El rodio es uno de los metales más raros de la corteza terrestre que se encuentra en los minerales de platino y se extrae como un metal blanco inerte. El rodio, junto con otros metales de platino, se encuentra en las arenas de los ríos de los Montes Urales en Rusia, Sudáfrica, América del Norte y del Sur. Se encuentra una concentración muy pequeña de metal en el área minera de sulfuro de cobre y níquel de la región de Sudbury, Ontario.
Lectura relacionada: Tulio - Elemento, Símbolo, Uso, Hechos
Tulio - Elemento, Símbolo, Uso, HechosLa cantidad estimada del metal en la corteza terrestre es de aproximadamente 0,0002 partes por millón. La rareza de la abundancia afecta los usos comerciales y el precio del rodio. El principal exportador de rodio es Sudáfrica, seguido de Rusia y la producción mundial anual del metal es de unas 30 toneladas.
isótopos
El rodio metálico tiene solo un isótopo estable natural con masa atómica 103. Se han producido muchos otros isótopos radiactivos mediante diversas reacciones nucleares artificiales. De estos isótopos radiactivos, los más estables son: 101Rh, 102Rh, 102mRh, y 99Rh. La vida media de la mayoría de estos isótopos radiactivos es de menos de una hora.
El principal modo de desintegración radiactiva de los isótopos Rh es la captura de electrones y la emisión beta. El principal producto de descomposición de los radioisótopos es el rutenio y el paladio.
Lectura relacionada: Holmio - Elemento, Símbolo, Uso, Hechos
Holmio - Elemento, Símbolo, Uso, HechosEl rodio se obtiene de la fisión nuclear del uranio-235. Una cantidad significativa de los metales más ligeros del grupo del platino se obtiene durante la fisión del uranio. Por lo tanto, el combustible nuclear es una fuente potencial de metal Rh.
Propiedades
El rodio es un metal blanco plateado, duro y muy brillante que refleja hasta el 80 por ciento de la luz.
| Rodio | |||
| Símbolo | Rh | ||
| Descubrimiento | William Hyde Wollaston en 1803 | ||
| Nombre derivado de | La palabra griega rhodon significa color rosa. | ||
| isótopo común | 45Rh103 | ||
| Estados de oxidación | +5, +4, +3+2, +1, 0 | ||
| número CAS | 7440-16-6 | ||
| Propiedades periódicas | |||
| número atómico | 45 | ||
| Masa atómica relativa | 102,906 | ||
| electrón por celda | 2, 8, 18, 16, 1 | ||
| Configuración electrónica | [Kr] 4d8 5s1 | ||
| Bloquear | bloque d | ||
| Grupo | 9 | ||
| Período de tiempo | 5 | ||
| Características físicas | |||
| Condición a 20 °C | firma | ||
| Punto de fusion | 1963 °C, 2236 K | ||
| Punto de ebullición | 3695 °C, 3968 K | ||
| Capacidad calorífica molar | 16.443 J mol−1 k1 | ||
| estructura cristalina | cúbico centrado en las caras (fcc) | ||
| Espesor | 1,85 g/cm23 | ||
| Resistencia eléctrica | 43,3nm | ||
| Propiedades atómicas | |||
| Radio atómico (sin consolidar) | 2.10 | ||
| Radio covalente | 1.34 | ||
| electronegatividad | 2.28 (escala de Pauling) | ||
| Afinidad electronica | 109.704 kJ mol−1 | ||
| Energía de ionización (kJ/mol) | 1º | 2do | 3ro |
| 719.67 | 1744.45 | 2996.83 | |
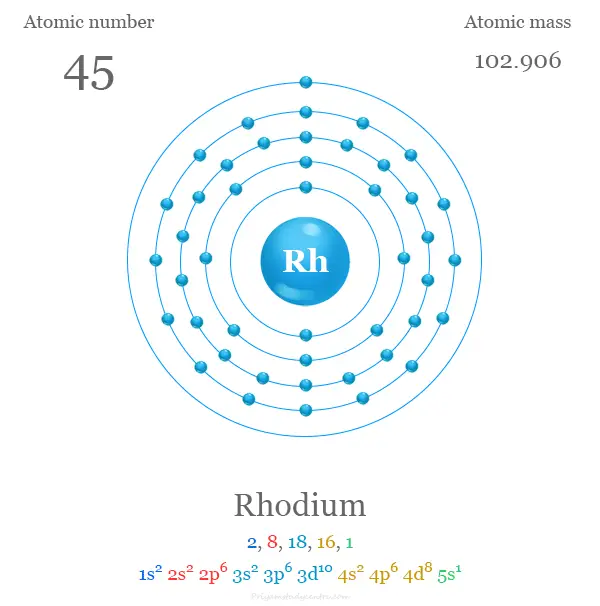
Configuración electronica
Los 45 electrones del átomo de rodio se dividen en diferentes niveles de energía para mostrar la siguiente configuración electrónica debajo de la imagen,
Rodio en la tabla periódica
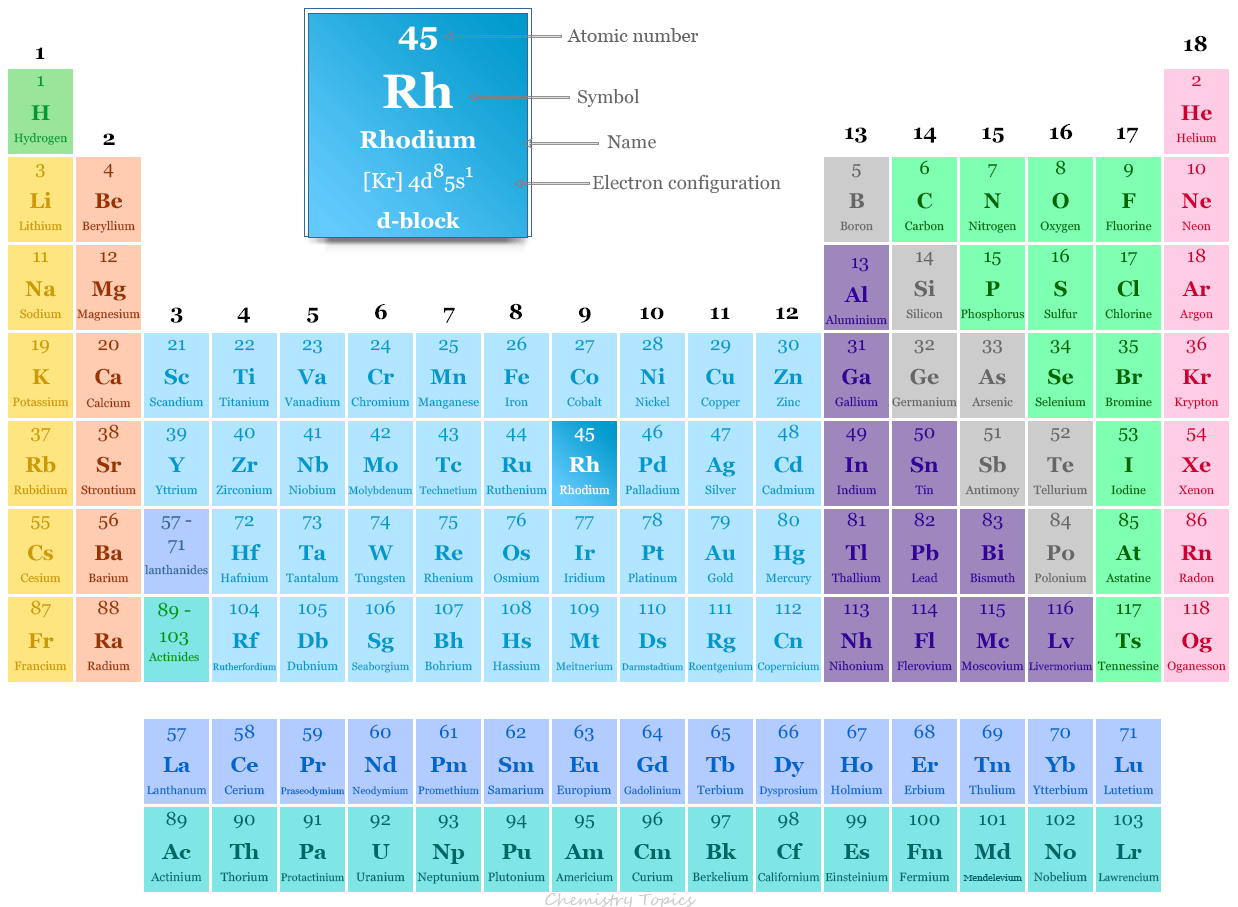
El rodio de metal platino se coloca en el grupo 9 y el período 5 en la tabla periódica. Es un elemento del bloque D o metal de transición que se encuentra entre el rutenio y el paladio.
Proceso de producción
La minería industrial es compleja porque los minerales que contienen rodio se mezclan con otros metales como el paladio, la plata, el platino y el oro. Se encuentra en minerales de platino y se extrae como un rodio metálico inerte blanco.
La refinación de rodio de otros metales de platino se da a continuación,
- La solución de sulfato de rodio (III) obtenida a partir de limo anódico de metales de platino precipita Rh (OH)3 con hidróxido de sodio acuoso.
- El precipitado se disuelve en ácido clorhídrico para dar H. dar3[RhCl6].
- Adición de NaNO2 y luego NH4Cl producido en esta solución (NH4)3[Rh(NO2)6].
- Cuando este complejo se digiere en HCl, se forma el complejo de cloro soluble.
- La solución se evapora y se enciende en hidrógeno para producir rodio metálico.
Ingredientes químicos
Además del carácter noble y el comportamiento catalítico, los metales de platino comparten varias características comunes en su química. Todos ellos forman una amplia variedad de compuestos binarios como óxidos, sulfuros y especialmente haluros.
En comparación con el par anterior de elementos de transición pesados, Rh e Ir tienen una menor tendencia a alcanzar estados de oxidación más altos. Aunque el estado más alto encontrado es VI y el estado más estable para Rh es III.
Óxidos de rodio
El rodio tiene solo unos pocos compuestos en el estado de oxidación IV. Al calentar el aire, Rh forma Rh2O3. El óxido RhO2 puede obtenerse mediante una fuerte oxidación de Rh(III) en una solución alcalina y deshidratación a alta presión.
En el estado de oxidación III, el elemento forma óxido, haluro y muchos compuestos complejos. Gris oscuro Rh2O3 se forma calentando el metal Rh en oxígeno a 600°C. El óxido de rodio (III) tiene una estructura de corindón.
haluros de rodio
Además del yoduro, los trihaluros de Rh se pueden preparar por reacción directa del metal con halógenos como el cloro, el flúor y el bromo. RhI3 se obtiene añadiendo KI acuoso al tribromuro.
Son de color rojo o marrón rojizo, sólidos excepto RhI3 es negro. Los trihaluros anhidros suelen ser insolubles en agua, pero se pueden preparar hidratos solubles en agua disolviendo el óxido hidratado en HX apropiado (X = F, Cl, Br, I).
El RhF marrón rojizo6 es un compuesto inestable que oxida vigorosamente el agua. En ausencia de agua, RhF6 puede oxidar moléculas de cloro y NO.
2 RhF6 +3 cl2 → 2 RhF3 + 6 CLF
NO + RhF6 → NO+[RhF6]
Conexiones complejas
Rh2O3xH2El O se disuelve en ácidos para formar amarillo Rh(H .)2O)6+3 ion. Forma alumbre de estructura similar a la del Co(H2O)6+3 pero más estable antes de la reducción.
En general, los complejos de Rh(III) son octaédricos. Los complejos octaédricos están formados por ligandos como el agua y el amoníaco.
El estado de oxidación II no es común para Rh y no se conoce ningún óxido o haluro establecido en este estado. complejos como [Rh(dipy)2Cl]+ y [Ph3PRh(OCOCH3)2]2 Son conocidos. El acetato dimérico de Rh(II) se obtiene mediante RhCl. calentar3.3H2O con una solución metanólica de acetato de sodio.
Datos interesantes sobre el rodio
- El tercer metal de platino, el rodio, se descubrió a partir de platino crudo en el mismo año (1803) en que se descubrió el paladio.
- El nombre del metal proviene del color rosa-rojo de la solución de sales de Rh. El nombre se deriva de la palabra griega rhodon que significa rosa.
- Es posible que no desempeñe un papel biológico en humanos y otros animales.
uso de rodio
El uso de rodio metálico está significativamente influenciado por su rareza en apariencia y alto precio. Los usos más comunes de este metal se dan a continuación,
Industria automotriz
El rodio metálico se utiliza principalmente en la industria automotriz como catalizador para reemplazar los hidrocarburos no quemados dañinos, el monóxido de carbono y el óxido de nitrógeno.
Hoy en día, la mayoría de los fabricantes de automóviles utilizan este metal como catalizador para minimizar la contaminación. Por lo tanto, el precio del rodio metálico depende en gran medida de la demanda de la industria automotriz.
Catalizador químico:
Es un catalizador químico útil para producir ácido nítrico a partir de amoníaco y ácido acético a partir de metanol. El catalizador de rodio se usa para catalizar hidrosilanos para fabricar ciertos cauchos de silicona. El catalizador también se usa para reducir el benceno a ciclohexano.
Los complejos de fosfina metálica se utilizan como catalizadores en reacciones de hidrogenación e hidroformilación. Se prefiere sobre otros metales de platino para la reducción de óxidos de nitrógeno a nitrógeno y oxígeno.
industria del vidrio
También es el uso más común del metal. El rodio se usa para fabricar vidrio y fibra de vidrio de panel plano.
Rodio para joyería
El rodio, un metal más raro, es el metal más blanco y precioso que se usa en joyería. El baño de rodio sobre oro blanco y platino al mismo tiempo le da una superficie blanca reflectante para vender las joyas. Cuando se recubre con una capa delgada, le da fuerza y brillo extra.
También se puede usar para recubrir plata para proteger contra el deslustre o para proteger la plata del sulfuro de hidrógeno atmosférico.
Las joyas chapadas en rodio ofrecen una capa adicional de protección a las joyas. También produce un blanco más brillante que la plata esterlina, el oro blanco o el platino. El baño de rodio no dañará, abollará ni corroerá las joyas que pretendemos vender.
Aleación de platino y paladio
Se utiliza para aleaciones de platino y paladio para mejorar la dureza y la resistencia a la corrosión. Estas aleaciones se utilizan en devanados de hornos, bujes de fibra de vidrio, reactores de turbinas, electrodos de bujías de aviones, hornos eléctricos, crisoles de laboratorio, etc.
Otros usos
- Se utiliza para recubrir fibras ópticas y espejos ópticos.
- También se utiliza para recubrir crisoles, elementos termopares y reflectores de faros.
- Se utiliza para hacer contactos eléctricos porque tiene una resistencia eléctrica pequeña y estable. Pero generalmente usamos rutenio en lugar de rodio debido a la realidad de la apariencia y el alto precio del metal Rh.
- Los detectores de neutrones de rodio se utilizan en reactores nucleares para medir los niveles de flujo de neutrones.
precio del rodio
El rodio se utiliza en el convertidor catalítico de todos los automóviles nuevos que se producen en la actualidad. Por lo tanto, el valor del rodio depende en gran medida de la demanda de la industria automotriz. El precio del metal también podría verse afectado por la oferta del principal exportador Sudáfrica y Rusia.
El precio del rodio varía mucho con el tiempo. En 2007, el precio del rodio era ocho veces superior al del oro, 450 veces superior al de la plata y 27.250 veces superior al del cobre. En 2008, el precio sube por encima de $10,000 por onza o $350 por gramo.
El precio del rodio estaba por debajo de los $1.000 la onza a finales de 2013 debido a diversos problemas políticos y financieros oa la baja demanda del metal en la industria automotriz.
El precio del rodio metálico cayó por debajo de los 8.000 dólares la onza en mayo de 2020. En abril de 2021, el precio subió a un nuevo máximo de $28 775, antes de caer hacia fines de 2021. En agosto de 2022, el precio promedio del rodio metálico volvió a caer a $14 000 por onza troy.












