Elemento Plata
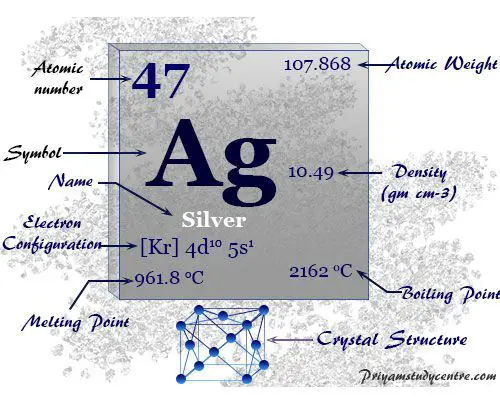
Plata es el metal de transición blanco brillante del grupo 11 o IB en la tabla periódica con número atómico 47 y el símbolo Ag. Se ha utilizado para joyería y monedas desde la antigüedad debido a su belleza decorativa.
Forma una red cristalina FCC con un color blanco plateado característico.
Lectura relacionada: Clasificación de aminoácidos
Clasificación de aminoácidosEl nombre plata proviene del asirio serpu o gótico silbur, que significa blanco y del nombre latino Argentum que significa blanco brillante (griego último Argos).
¿Dónde se encuentra la plata?
La presencia relativa de metal en la corteza terrestre es de 0,08 ppm, mientras que la del oro es de 0,004 ppm.
Está ampliamente distribuido en la naturaleza como mineral de sulfuro, como la mirada de plata o la argentita (Ag2S). La plata de cuerno (AgCl) se encuentra en algunos minerales en Chile y Nueva Gales del Sur, formada por la acción del agua salada. Ahora se descubre en gran parte como un subproducto de la minería de cobre y plomo.
Lectura relacionada: Prueba de Mayer para alcaloides: Procedimiento, Mecanismo, Resultados, Usos
Prueba de Mayer para alcaloides: Procedimiento, Mecanismo, Resultados, UsosLa plata se encuentra en varios países como Estados Unidos, Canadá, Perú, México, Bolivia y Nueva Gales del Sur. En India, se obtiene de las minas de oro de Kolar que se producen fundiendo minerales de plomo de Zawar.
Propiedades de la plata
Químicamente, la plata metálica es un elemento químico bastante poco reactivo con un buen conductor de electricidad.
Al aprender química, se disolvió en agua a 0,07 mg por litro.−1 en presencia de oxígeno disuelto. Es atacado por compuestos de azufre atmosférico, principalmente sulfuro de hidrógeno (H2S).
Lectura relacionada: Prueba de Osazona: Principio, Usos, Protocolo, Resultados
Prueba de Osazona: Principio, Usos, Protocolo, Resultados| Plata |
|||
| Símbolo | agricultura | ||
| Descubrimiento | Hacia el 3000 a. | ||
| Nombre derivado de | Serpu asirio o silbur gótico que significa blanco y del nombre latino Argentum significa blanco brillante (griego último Argos) | ||
| isótopo común | 47agricultura107 | ||
| Estados de oxidación | 2, 1 | ||
| número CAS | 7440-22-4 | ||
| Propiedades periódicas |
|||
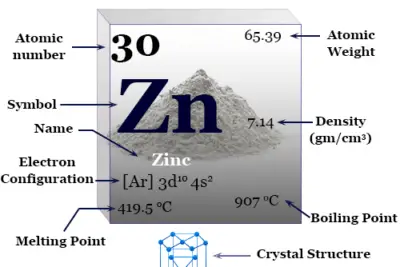
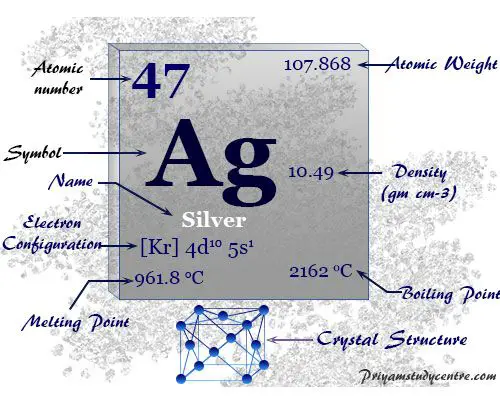
| número atómico | 47 | ||
| Peso atomico | 107,868 | ||
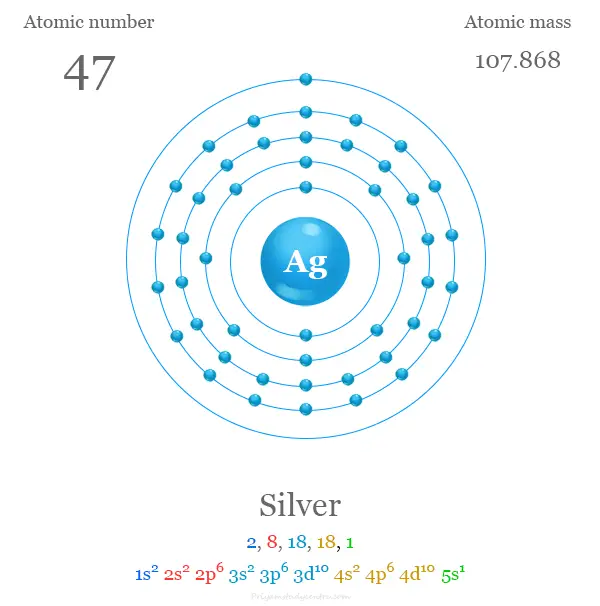
| electrón por celda | 2, 8, 18, 18, 1 | ||
| Configuración electrónica | [Kr] 4d10 5S1 | ||
| Grupo | 11 | ||
| Período de tiempo | 5 | ||
| Bloquear | bloque d | ||
| Características físicas |
|||
| Condición a 20 °C | firma | ||
| Punto de fusion | 961,8 °C o 1763,2 °F | ||
| Punto de ebullición | 2162°C o 3924°F | ||
| Espesor | 10,49 g/cm3 | ||
| Resistencia eléctrica | 15,87 nm | ||
| Capacidad calorífica molar | 25.350 J mol−1 k−1 | ||
| estructura cristalina | Cúbico centrado en las caras (fcc) | ||
| Propiedades atómicas |
|||
| Radio atómico (sin consolidar) | 2.11 | ||
| Radio covalente | 1.36 | ||
| electronegatividad | 1,93 (escala de Pauling) | ||
| Afinidad electronica | 125,62 kJ mol−1 | ||
| Energía de ionización (kJ mol−1) | 1º | 2do | 3ro |
| 730.99 | 2072.26 | 3360.58 | |
Configuración electrónica de la plata
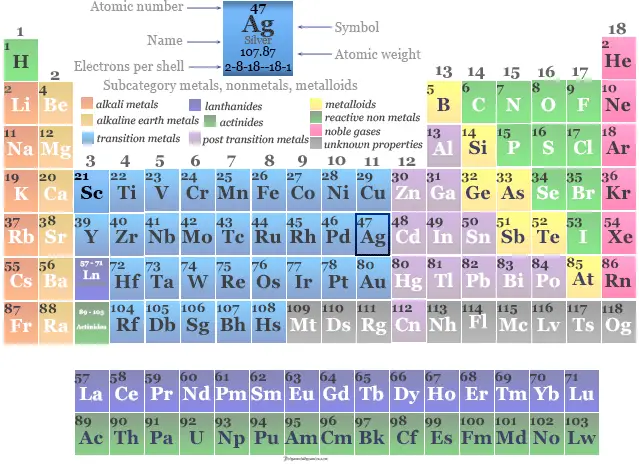
Los 47 electrones del átomo de plata se dividen en diferentes niveles de energía para mostrar la siguiente configuración electrónica debajo de la imagen,
Plata en la tabla periódica
Se coloca en el grupo 11 en la tabla periódica de elementos del bloque d.
Los estados atómicos del cobre, la plata y el oro o los metales preciosos contienen ns1 (n−1)d10 configuración electrónica externa o subcapa d llena. Se consideran metales de transición porque poseen un orbital d incompleto en número o estado de oxidación +2 o +3.
producción de plata
- Por lo general, la plata se obtenía como subproducto de la producción de cobre, plomo y zinc mediante la recolección de lodo o lodo anódico.
- El limo o lodo del ánodo se calienta con ácido sulfúrico diluido en una corriente de aire para disolver algunos metales.
- La escoria del ánodo restante se calentó con cal y sílice para eliminar la mayor parte del metal base como escoria.
- Finalmente, los materiales que contienen Ag se disuelven en ácido nítrico diluido.
- Electrólisis de AgNO3 solución da una forma pura de plata metálica en el cátodo.
Extracción de plata del mineral
- Se extrae de sus minerales principales mediante la lixiviación del mineral finamente pulverizado con una solución diluida (0,4 por ciento) de cianuro de sodio.
- El lodo se enciende bien con aire. que un2S se oxida por aireación, de lo contrario se invertiría la reacción.
- El lodo se elimina por filtración y la plata filtrada se precipita con zinc o aluminio.
- El precipitado se lava y se funde con una corriente de nitrato para eliminar el exceso de zinc.
Ingredientes químicos
Las propiedades físicas y químicas de la plata son similares a las de sus dos vecinos verticales, el cobre y el oro, en la tabla periódica. La mayor carga nuclear efectiva o potencial iónico y el gran electrón de protección sugieren que el enlace covalente de los compuestos de Ag y Au es estable en los estados +1 y +2.
El estado +1 es el estado de oxidación más común de la plata que proporciona óxidos, sulfuros, haluros y varias sales de oxoácidos.
Las sales son principalmente iónicas y fácilmente solubles en agua, pero Ag2ASI QUE4 y CH3Los COOAg son poco solubles en agua. El haluro (excepto AgF) se forma por enlace químico covalente.
estado de oxidacion de la plata
El estado de oxidación +1 de la plata es el más común y estable. La primera energía de ionización es la más baja para Ag. La suma de la primera y la segunda ionización es la más baja para Cu. La suma de las energías de ionización primera, segunda y tercera es la más baja para los átomos de Au.
El hecho anterior indica que la química Ag predomina en el estado de oxidación +1, pero la química del cobre y el oro predomina en los estados de oxidación +2 y +3.
Los hechos también son descritos por la energía de hidratación.
- La energía de hidratación del ion cobre(II) es mucho mayor que la del ion cobre(I) que supera la segunda ionización del Cu en un medio acuoso.
- Debido a los radios iónicos más altos de Ag, la energía de hidratación no puede estabilizar el ion Ag(II) en relación con Ag(I).
- Para los átomos de oro, las energías de pulverización, ionización e hidratación promueven la formación de Au(III) en un medio acuoso.
óxido de plata
El óxido de plata marrón oscuro (fórmula Ag2O) se obtiene agregando álcali a una Ag acuosa+ ion. Es más soluble en álcali que en agua pura debido a la formación de Ag(OH)2.
agricultura2O se disuelve en amoníaco para producir [Ag(NH3)2]OH. Cuando la solución se expone al aire, convierte el nitruro de plata explosivo negro (Ag3NORTE). Se llama plata fulminante.
agricultura húmeda2El O se utiliza como agente oxidante suave para compuestos orgánicos.
Un óxido negro como AgO se forma por oxidación de Ag2O con molécula de ozono o por electrólisis 2M AgNO3 solución.
Compuestos de plata (II)
Los compuestos de Ag(II) se obtienen por oxidación directa o elemento químico desproporcionado, que es extremadamente desfavorable debido al bajo calor de hidratación de Ag+2 ion.
AgF2 es el único haluro de plata conocido obtenido por la acción del flúor sobre AgF o Ag a una temperatura de 250°C. Se utiliza como agente fluorante.
Compuestos de plata (III)
Los compuestos de Ag(III) son muy pocos, Ag2O3Ag(OH)4KAgF4 o Cs2KAgF6 son los ejemplos habituales del estado de oxidación +3 de la plata.
El número de oxidación formal +1/2 está presente en el sólido amarillo verdoso Ag2F.
uso de la plata
- La plata y sus compuestos son muy utilizados en fotografía, en espejos o platos de plata, en platería, joyería, odontología y numismática.
- También se utiliza en celdas eléctricas de alta capacidad (Ag-Zn, Ag-Cd).
- El cobre sirve para aumentar la dureza de una aleación para mejorar la resistencia al desgaste.
- La placa de fotosensibilidad fotográfica consiste en una emulsión de haluros de plata de grano fino como bromuro, cloruro o yoduro (diámetro < 1 m) sobre un medio transparente como vidrio o celuloide.
- El haluro, generalmente AgBr con alguna cantidad de AgCl y colorantes orgánicos, pero AgI se usa en películas muy rápidas. Los tintes orgánicos actúan como fotosensibilizadores para ayudar a la absorción de la luz en toda la banda visible.
- El plateado en química ocurre en el cátodo de la celda electrolítica. Un trozo de elemento Ag puro actúa como ánodo con la solución electrolítica de dicianargentato de sodio, Na[Ag(CN)2].
Detección de iones de plata
Las sales de plata en una solución acuosa producen un precipitado blanco cuajado de AgCl con iones de cloro. El precipitado es insoluble en ácido nítrico, pero se disuelve fácilmente en amoníaco acuoso.
agricultura+ también forma un abismo rojo (Ag2CRO4) con solución de dicromato de potasio insoluble en ácido acético.
Todos los compuestos de plata producen un lecho maleable de color blanco brillante cuando se calientan con carbonato de sodio sobre carbón. El sedimento puede disolverse en ácido nítrico y probarse con cloruro de hidrógeno (HCl).
Análisis gravimétrico
Al aprender química o ciencias químicas, la plata se puede estimar gravimétricamente como cloruro o por electrodeposición (coulómetro), volumétricamente.
- En el método de Mohrs, un volumen conocido de solución estándar de cloruro de sodio se tritura con AgNO3 solución con cromato de potasio como indicador.
- Según el método de Volhard, el nitrato de plata (AgNO3) se tritura con tiocianato estándar de potasio o amonio con alumbre férrico como indicador.
la agricultura+ El ion forma un precipitado blanco de AgSCN, pero cuando la concentración cae por debajo de la solubilidad, produce un color rojo sangre de iones de tiocianato con ion férrico.