
¿Qué es el tulio?
Tulio es un elemento químico o metal de tierras raras en la tabla periódica con el símbolo Tm y número atómico 69. Es un segundo lantánido más raro después del samario radiactivamente inestable. Al igual que otros lantánidos, el tulio generalmente exhibe un número o estado de oxidación de +3, pero el estado de oxidación de +2 del metal también es estable.

El tulio rara vez se usa en máquinas de rayos X y láseres de estado sólido debido a su alto precio. Al igual que el escandio, se utiliza en la iluminación de arco para producir espectros de emisión verde. Informes recientes muestran que el láser de fibra óptica de tulio ofrece un nivel impresionante de rendimiento en la litotricia con láser.
Lectura relacionada: Holmio - Elemento, Símbolo, Uso, Hechos
Holmio - Elemento, Símbolo, Uso, HechosEl tulio metálico fue descubierto en 1879 por el químico sueco Per Teodor Cleve a partir del mineral erbia, que es una fuente de otro elemento de tierras raras, el holmio. Lleva el nombre de la palabra Thule, el antiguo nombre de Escandinavia.
¿Dónde se encuentra el tulio?
Una forma pura de tulio nunca se encuentra en la naturaleza, pero se encuentra en pequeñas cantidades con otros minerales de tierras raras como la monacita y la bastnasita. Es el segundo lantánido más raro después del samario. Los principales minerales del metal se extraen en la región de China, EE. UU., Brasil, India, Sri Lanka y Australia.
Al igual que otros metales de tierras raras, puede extraerse o separarse mediante cromatografía de intercambio iónico y extracción con disolvente. El metal también se produce reduciendo el fluoruro anhidro con calcio o reduciendo el óxido de tulio con lantano.
Lectura relacionada: Disprosio - Elemento, Símbolo, Uso, Hechos
Disprosio - Elemento, Símbolo, Uso, Hechosisótopos
El tulio natural contiene un isótopo estable, 169tm. Treinta y cuatro isótopos radiactivos y 26 isómeros nucleares han sido preparados por varias reacciones nucleares artificiales.
La mayoría de estos isótopos tienen vidas medias de menos de un minuto. El principal modo de desintegración radiactiva de los isótopos Tm es la captura de electrones o desintegración beta.
Propiedades
El tulio es un metal plateado que es bastante estable en el aire y reacciona lentamente en el agua pero más rápido en los ácidos. Es un metal blando que es fácil de cortar con un cuchillo.
Lectura relacionada: Francio, Símbolo, Propiedades, Hechos, Uso
Francio, Símbolo, Propiedades, Hechos, Uso| Tulio | |||
| Símbolo | Tm | ||
| Descubrimiento | Por Teodor Cleves en 1879 | ||
| Nombre derivado de | Van Thule, el antiguo nombre de Escandinavia | ||
| isótopo común | 69Tm169 | ||
| Estados de oxidación | +3, +2 | ||
| número CAS | 7440-30-4 | ||
| Propiedades periódicas | |||
| número atómico | 69 | ||
| Masa atómica relativa | 168,934 | ||
| electrón por celda | 2, 8, 18, 31, 8, 2 | ||
| Configuración electrónica | [Xe] 4f13 6s2 | ||
| Bloquear | bloque f | ||
| Grupo | lantánidos | ||
| Período de tiempo | 6 | ||
| Características físicas | |||
| Condición a 20 °C | firma | ||
| Punto de fusion | 1545 °C, 1818 K | ||
| Punto de ebullición | 1950 °C, 2223 K | ||
| Capacidad calorífica molar | 27,03 J mol−1 k1 | ||
| estructura cristalina | empaquetado herméticamente hexagonal (hcp) | ||
| Espesor | 9,32 g/cm23 | ||
| Calor de fusión | 16,84 kJ mol−1 | ||
| Calor de evaporación | 191 kJ mol−1 | ||
| Propiedades atómicas | |||
| Radio atómico (sin consolidar) | 2.27 | ||
| Radio covalente | 1.77 | ||
| electronegatividad | 1,25 (escala de Pauling) | ||
| Afinidad electronica | 99.283 kJ mol−1 | ||
| Energía de ionización (kJ/mol) | 1º | 2do | 3ro |
| 596.69 | 1162.65 | 2284.77 | |
Tulio en la tabla periódica
El tulio, un metal de tierras raras, se coloca en el bloque f de la tabla periódica. Es un lantánido que se encuentra entre el erbio y el iterbio.
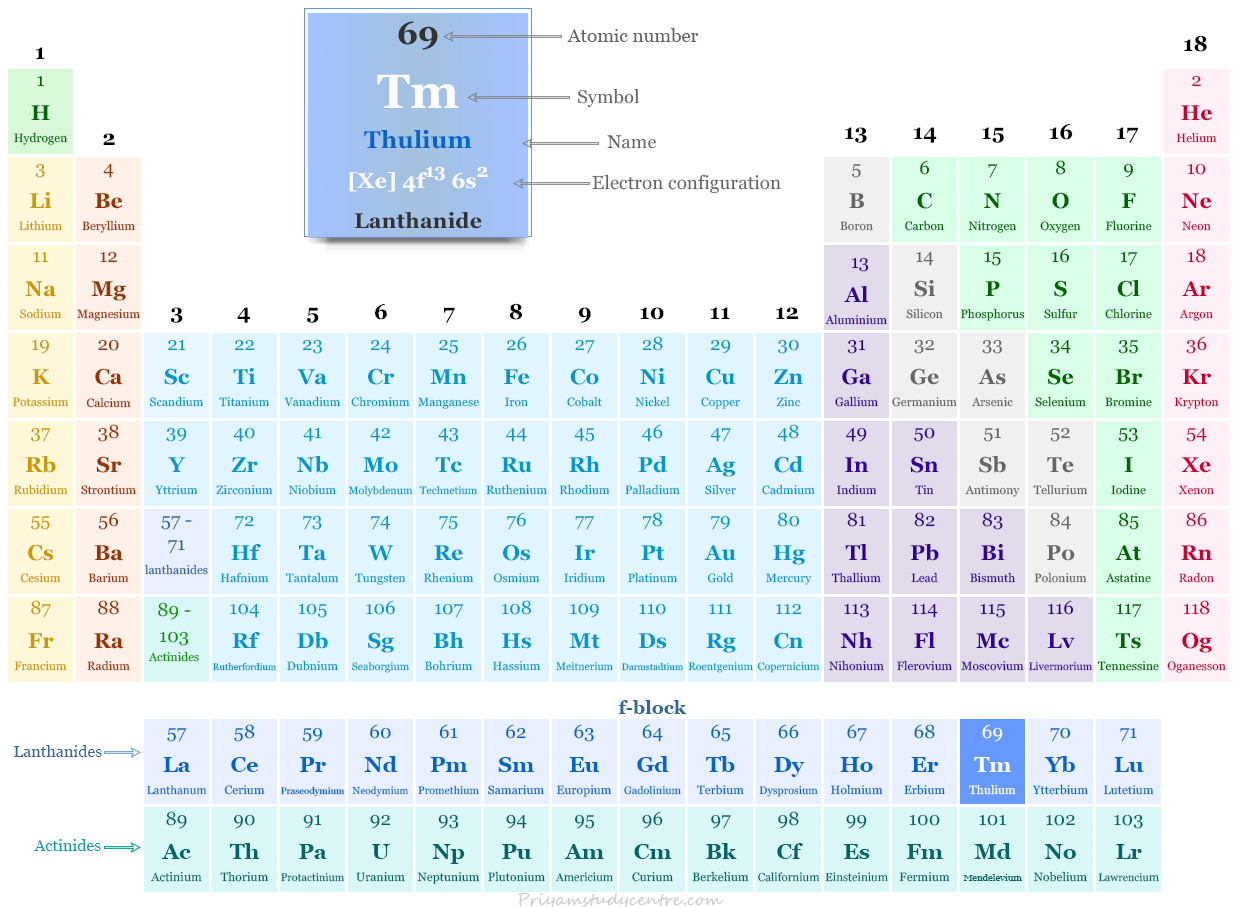
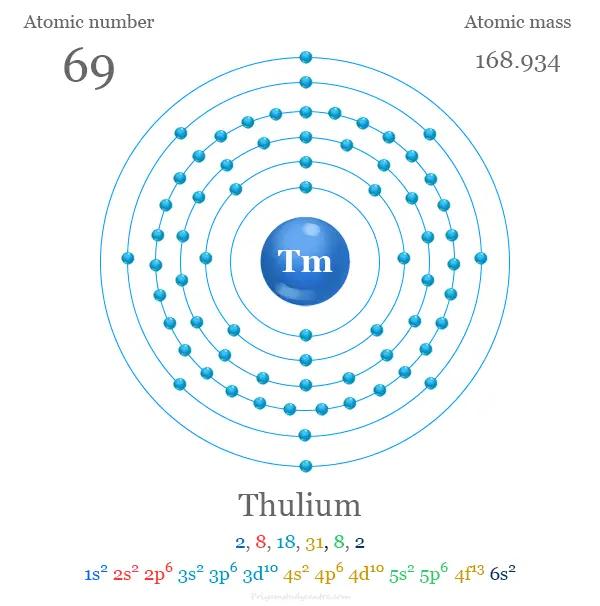
Configuración electrónica del tulio
Los 69 electrones del tulio se dividen en diferentes niveles de energía u orbitales para mostrar la siguiente configuración electrónica debajo de la imagen:
Propiedades químicas
Al igual que otros lantánidos, el número de oxidación o estado más común del tulio es +3 y existe como una Tm3+ ión en solución. Reacciona con varios elementos metálicos y no metálicos para formar una serie de compuestos binarios.
El óxido de tulio se forma calentando metal en oxígeno o descomposición térmica de Tm(OH)3.
4Tm + 3O2 → 2Tm2O3
El tulio está muy por encima del hidrógeno en la serie electroquímica. Por lo tanto, reacciona lentamente con agua fría y rápidamente con agua caliente liberando hidrógeno y formando hidróxido de Tm(III).
2Tm + 6H2O → 2 Tm(OH)3 + 3 horas2
El hidróxido se precipita como un precipitado gelatinoso de una solución acuosa mediante la adición de amoníaco o álcali diluido para formar una sal soluble de Tm+3 ion.
Forma dihaluros cuando reacciona con halógenos como flúor, cloro, bromo y yodo.
2Tm + 3X2 → 2 TmX3 (X = F, Cl, Br, I)
Es atacado por ácidos minerales como el sulfúrico, nítrico y clorhídrico liberando gas hidrógeno. En presencia de ácido sulfúrico diluido, el tulio forma una solución que contiene los iones Tm(III) de color verde claro.
2Tm + 3H2ASI QUE4 → 2Tm3+ + 3 SO4−2 + 3 horas2
Datos sobre el tulio
- El metal de tierras raras menos común, el tulio, es difícil de extraer o purificar de sus minerales.
- El estado de oxidación más común de Tm es +3, pero el estado +2 del metal también es estable.
- No hay muchos usos para el tulio y sus compuestos debido a su apariencia rara y su precio elevado.
- Tras el desarrollo de la técnica de cromatografía de intercambio iónico, el precio del metal cae.
- En la tecnología láser de estado sólido, el holmio-cromo-tulio-granate produce láseres de alta eficiencia. Estos láseres son herramientas útiles para aplicaciones quirúrgicas debido a su potencia y longitud de onda.
- Al igual que el escandio, el tulio se usa en la iluminación de arcos para producir líneas de emisión verdes que no son emitidas por otros elementos químicos.
- No es un metal tóxico con una función biológica conocida en humanos.
uso de tulio
- Un isótopo de tulio obtenido por irradiación de un reactor nuclear se utiliza como fuente de radiación para máquinas de rayos X portátiles.
- Es un componente importante para los láseres de alta eficiencia. Estos láseres se utilizan en los campos médico, astronómico y militar.
- Al igual que el itrio, se utiliza para fabricar superconductores de alta temperatura.
- Es un componente de ferritas y materiales cerámicos magnéticos utilizados en equipos de microondas.
- Debido a sus propiedades de fluorescencia azul, el elemento se utiliza para las marcas contra la falsificación de billetes en euros.
- El tulio se usa en la iluminación de arco porque proporciona un espectro inusual como el escandio.
- El láser granate de holmio: itrio y aluminio se ha utilizado para la litotricia con láser durante los últimos 20 años, pero informes recientes muestran que el litotriptor de láser de fibra de tulio (TFL) ofrece un nivel impresionante de rendimiento.












