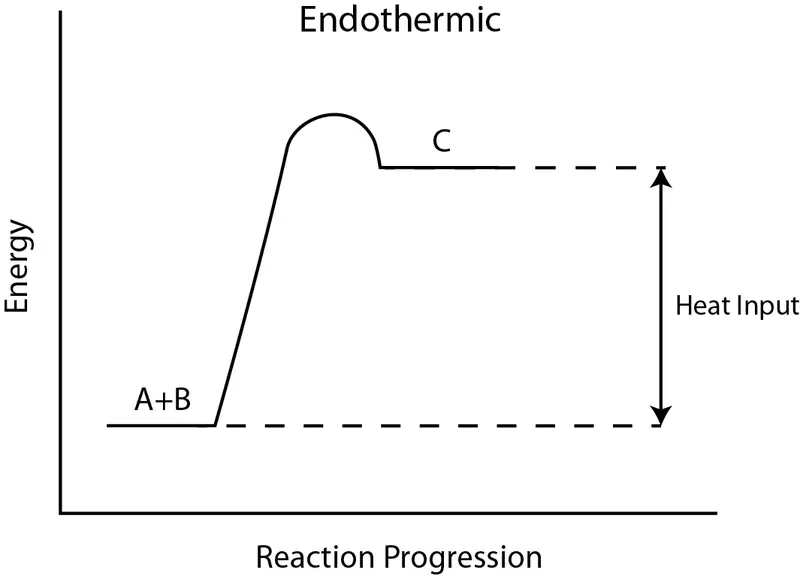
Que diferencia principal entre reacciones endotérmicas y exotérmicas es que Las reacciones endotérmicas absorben energía del medio ambiente, mientras que las reacciones exotérmicas liberan energía al medio ambiente..
Lectura relacionada: Diferencia entre amoníaco y amonio.
Diferencia entre amoníaco y amonio.La energía es la capacidad de realizar un trabajo. En un sistema, la energía puede realizar trabajo; puede transformarse en otras formas como calor, sonido, luz, etc. Cuando la energía de un sistema cambia debido a una diferencia de temperatura entre el sistema y el ambiente, decimos que la energía se ha transferido como calor. Una reacción endotérmica es un proceso que libera energía de su entorno al sistema, mientras que una reacción exotérmica es un proceso que libera energía del sistema al entorno.
CONTENIDO
1. Descripción general y diferencia clave
2. ¿Qué son las reacciones endotérmicas?
3. ¿Qué son las reacciones exotérmicas?
4. Comparación lado a lado: reacciones endotérmicas y exotérmicas en forma tabular
5. Resumen
¿Qué son las reacciones endotérmicas?
Una reacción endotérmica es un proceso en el que se extrae energía del medio ambiente en forma de calor. Si el ambiente no proporciona calor, la reacción no tendrá lugar. Durante esta reacción, el recipiente de reacción se enfría a medida que absorbe calor del ambiente, lo que hace que la temperatura disminuya.
Lectura relacionada: Diferencia entre nitrato y nitrito.
Diferencia entre nitrato y nitrito.Se necesita energía para romper un enlace químico. En las reacciones endotérmicas, la energía de ruptura de enlaces de los reactivos es mayor que la energía total de formación de enlaces de los productos. Por lo tanto, el cambio de entalpía es un valor positivo y la reacción no es espontánea. Por lo tanto, para las reacciones endotérmicas, necesitamos suministrar energía desde el exterior.

Por ejemplo, cuando se disuelve cloruro de amonio en agua, el vaso de precipitados se enfría porque la solución absorbe energía del ambiente exterior. La fotosíntesis es una reacción endotérmica que tiene lugar en el medio natural. La luz del sol proporciona la energía necesaria para la fotosíntesis.
Lectura relacionada: Diferencia entre amoníaco y nitrato de amonio.
Diferencia entre amoníaco y nitrato de amonio.¿Qué son las reacciones exotérmicas?
Una reacción exotérmica es un proceso que emite energía al medio ambiente, generalmente en forma de calor. Además, la energía también se puede liberar en otras formas, como sonido, luz, etc. Debido a que se libera energía durante la reacción, los productos contienen menos energía que los reactivos. Por lo tanto, el cambio de entalpía (∆H) se vuelve negativo.

En este tipo de reacción, se libera energía durante la formación del enlace. Si la energía total de formación de enlaces durante la reacción es mayor que la energía de ruptura de enlaces, entonces es exotérmica. Cuando la energía se libera en forma de calor, la temperatura ambiente aumenta, por lo que la reacción a veces puede ser explosiva. Las reacciones exotérmicas son espontáneas. No se requiere suministro de energía externa para las reacciones exotérmicas, ya que generan la energía requerida durante el curso de la reacción. Sin embargo, puede ser necesaria una entrada inicial de energía para iniciar la reacción.
Si podemos capturar esta energía liberada, podemos usarla para muchos trabajos útiles. Por ejemplo, la energía liberada cuando se queman combustibles es útil en el funcionamiento de un vehículo o máquina. Además, todas las reacciones de combustión son exotérmicas.
¿Cuál es la diferencia entre reacciones endotérmicas y exotérmicas?
Endotérmico y exotérmico son términos relacionados con la transferencia de calor en sistemas termodinámicos. La diferencia clave entre las reacciones endotérmicas y exotérmicas es que las reacciones endotérmicas absorben energía del entorno, mientras que las reacciones exotérmicas liberan energía al entorno. Además, el cambio de entalpía es positivo en un proceso endotérmico, mientras que el cambio de entalpía es negativo en un proceso exotérmico. Al considerar el producto final, el producto de la reacción endotérmica tiene mayor energía en comparación con la energía de los reactivos, mientras que en las reacciones exotérmicas los productos tienen menor energía que la energía de los reactivos.

Resumen: reacciones endotérmicas y exotérmicas
Endotérmico y exotérmico son términos relacionados con la transferencia de calor en sistemas termodinámicos. La diferencia clave entre las reacciones endotérmicas y exotérmicas es que las reacciones endotérmicas absorben energía del entorno, mientras que las reacciones exotérmicas liberan energía al entorno.
Relación:
Helmenstine, Annemarie. "Ejemplos de reacciones endotérmicas". ThoughtCo, mayo. 9 de septiembre de 2019, disponible aquí.
Imagen de cortesía:
1. Brazosport College "Reacción endotérmica" - Trabajo propio (CC BY-SA 3.0) a través de Commons Wikimedia
2. "Reacción exotérmica" por Brazosport College - Trabajo propio (CC BY-SA 3.0) a través de Commons Wikimedia