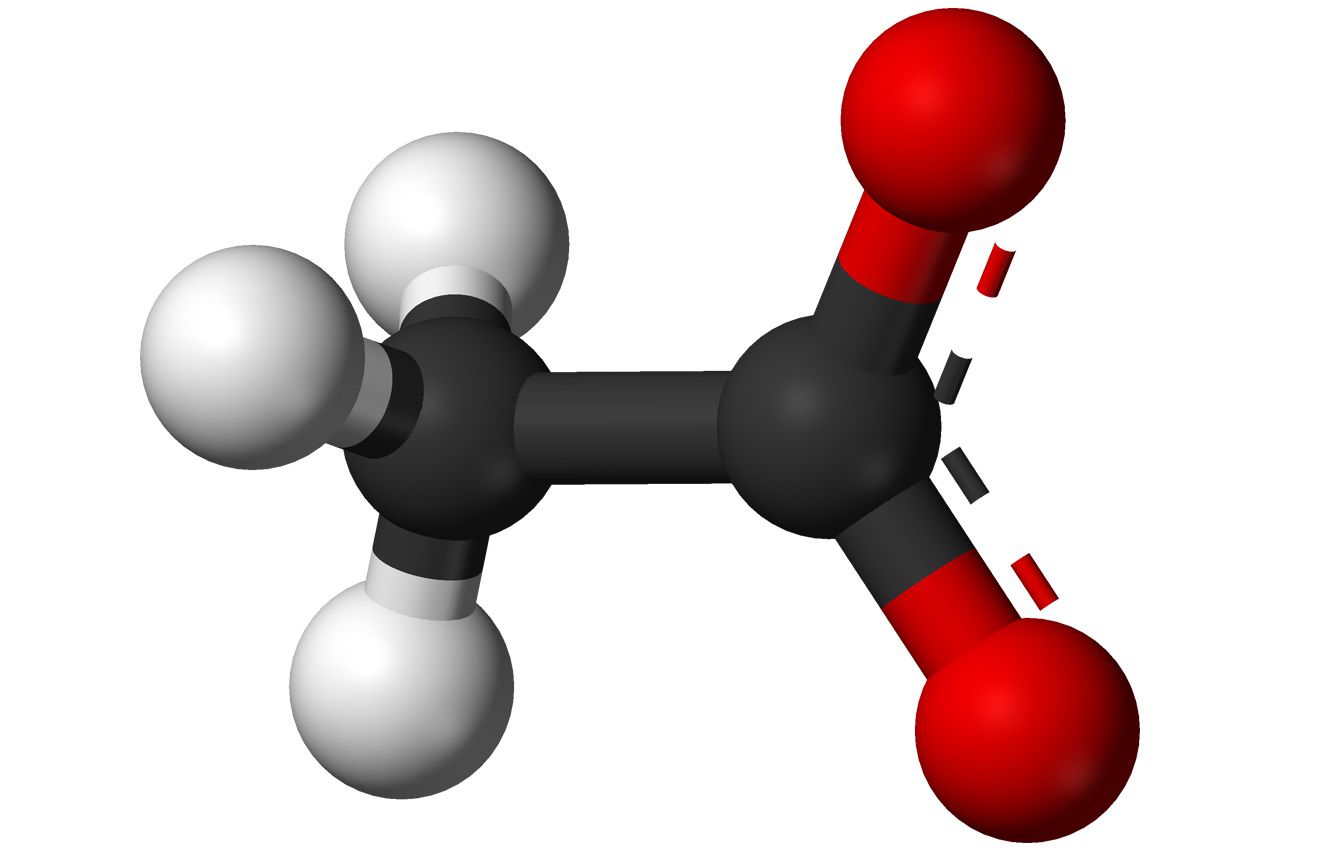
"Acetato" se refiere al anión acetato y al grupo funcional éster acetato. El anión acetato se forma a partir de ácido acético y tiene una fórmula química de CH3COO-. El anión acetato se abrevia comúnmente como OAc en las fórmulas. Por ejemplo, el acetato de sodio se abrevia NaOAc y el ácido acético es HOAc. El grupo éster acetato conecta un grupo funcional al último átomo de oxígeno del anión acetato. La fórmula general para el grupo éster acetato es CH3COO-R.
Conclusiones clave: Acetato
- La palabra "acetato" se refiere al anión acetato, al grupo funcional acetato y a compuestos que incluyen el anión acetato.
- La fórmula química para el anión acetato es C2H3O2-.
- El compuesto más simple elaborado con acetato es acetato de hidrógeno o etanoato, que con mayor frecuencia se denomina ácido acético.
- El acetato en forma de acetil CoA se usa en el metabolismo para producir energía química. Sin embargo, demasiado acetato en el torrente sanguíneo puede conducir a la acumulación de adenosina, lo que causa síntomas de resaca.
Ácido Acético y Acetatos
Cuando el anión acetato cargado negativamente se combina con un catión cargado positivamente, el compuesto resultante se denomina acetato. El más simple de estos compuestos es el acetato de hidrógeno, que comúnmente se llama ácido acético. El nombre sistemático del ácido acético es etanoato, pero la IUPAC prefiere el nombre ácido acético. Otros acetatos importantes son acetato de plomo( o azúcar de plomo), acetato de cromo (II) y acetato de aluminio. La mayoría de los acetatos de metales de transición son sales incoloras que son altamente solubles en agua. En un memento dado, se usó acetato de plomo como edulcorante (tóxico). El acetato de aluminio se usa en el teñido. El acetato de potasio es un diurético.
Lectura relacionada: Cómo Equilibrar Ecuaciones Iónicas Netas
Cómo Equilibrar Ecuaciones Iónicas Netas
La mayor parte del ácido acético producido por la industria química se usa para preparar acetatos. Los acetatos, a su vez, se usan principalmente para fabricar polímeros. Casi la mitad de la producción de ácido acético se destina a la preparación de acetato de vinilo, que se utiliza para fabricar alcohol polivinílico, un ingrediente de la pintura. Otra fracción de ácido acético se usa para fabricar acetato de celulosa, que se usa para fabricar fibras para la industria textil y discos de acetato en la industria del audio. En biología, los acetatos se producen de forma natural para su uso en la biosíntesis de moléculas orgánicas más complejas. Por ejemplo, la unión de dos carbonos de acetato a un ácido graso produce un hidrocarburo más complejo.
Sales de Acetato y Ésteres de Acetato
Debido a que las sales de acetato son iónicas, tienden a disolverse bien en agua. Una de las formas más fáciles de acetato para preparar en casa es el acetato de sodio, que también se conoce como "hielo caliente"."El acetato de sodio se prepara mezclando vinagre (ácido acético diluido) y bicarbonato de sodio (bicarbonato de sodio) y evaporando el exceso de agua.
Lectura relacionada: ¿Qué Es El Deuterio? - Hechos del Deuterio
¿Qué Es El Deuterio? - Hechos del Deuterio
Mientras que las sales de acetato son típicamente polvos solubles blancos, los ésteres de acetato están típicamente disponibles como líquidos lipófilos, a menudo volátiles. Los ésteres de acetato tienen la fórmula química general CH3CO2R, en el que R es un grupo organilo. Los ésteres de acetato son típicamente económicos, muestran baja toxicidad y, a menudo, tienen un olor dulce.
Bioquímica del Acetato
Las arqueas metanógenas producen metano a través de una reacción de desproporción de la fermentación:
Lectura relacionada: Hechos de Hassio-Hs o Elemento 108
Hechos de Hassio-Hs o Elemento 108
CH3COO- + H+ → CH4 + CO2
En esta reacción, un solo electrón se transfiere del carbonilo del grupo carboxílico al grupo metilo, liberando gas metano y gas dióxido de carbono.
En animales, el acetato se usa más comúnmente en la forma acetil coenzima A. La acetil coenzima A o acetil CoA es importante para el metabolismo de lípidos, proteínas y carbohidratos. Entrega el grupo acetilo al ciclo del ácido cítrico para la oxidación, lo que conduce a la producción de energía.
Se cree que el acetato causa o al menos contribuye a la resaca por el consumo de alcohol. Cuando el alcohol se metaboliza en mamíferos, los niveles aumentados de acetato sérico conducen a la acumulación de adenosina en el cerebro y otros tejidos. En ratas, se ha demostrado que la cafeína reduce el comportamiento nociceptivo en respuesta a la adenosina. Por lo tanto, aunque beber café después de consumir alcohol puede no aumentar la sobriedad de una persona (o rata), puede reducir la probabilidad de tener resaca.
Recursos y Lecturas Adicionales
- Cheung, Hosea, et al. "Ácido acético.” Enciclopedia de Química Industrial de Ullmann, 15 de junio de 2000.
- Holmes, Bob. "¿Es el Café la Verdadera Cura para la Resaca?” Nuevo Científico, 11 de enero 2011.
- Marcha, Jerry. Química Orgánica Avanzada: Reacciones, Mecanismos y Estructura. 4ª ed., Wiley, 1992.
- Nelson, David Lee y Michael M Cox. Principios de Bioquímica de Lehninger. 3ª ed., Worth, 2000.
- Vogels, G. D., et al. "Bioquímica de la Producción de Metano.” Biología de Microorganismos Anaerobios, editado por Alexander J. B. Zehnder, 99a ed., Wiley, 1988, pp. 707-770.