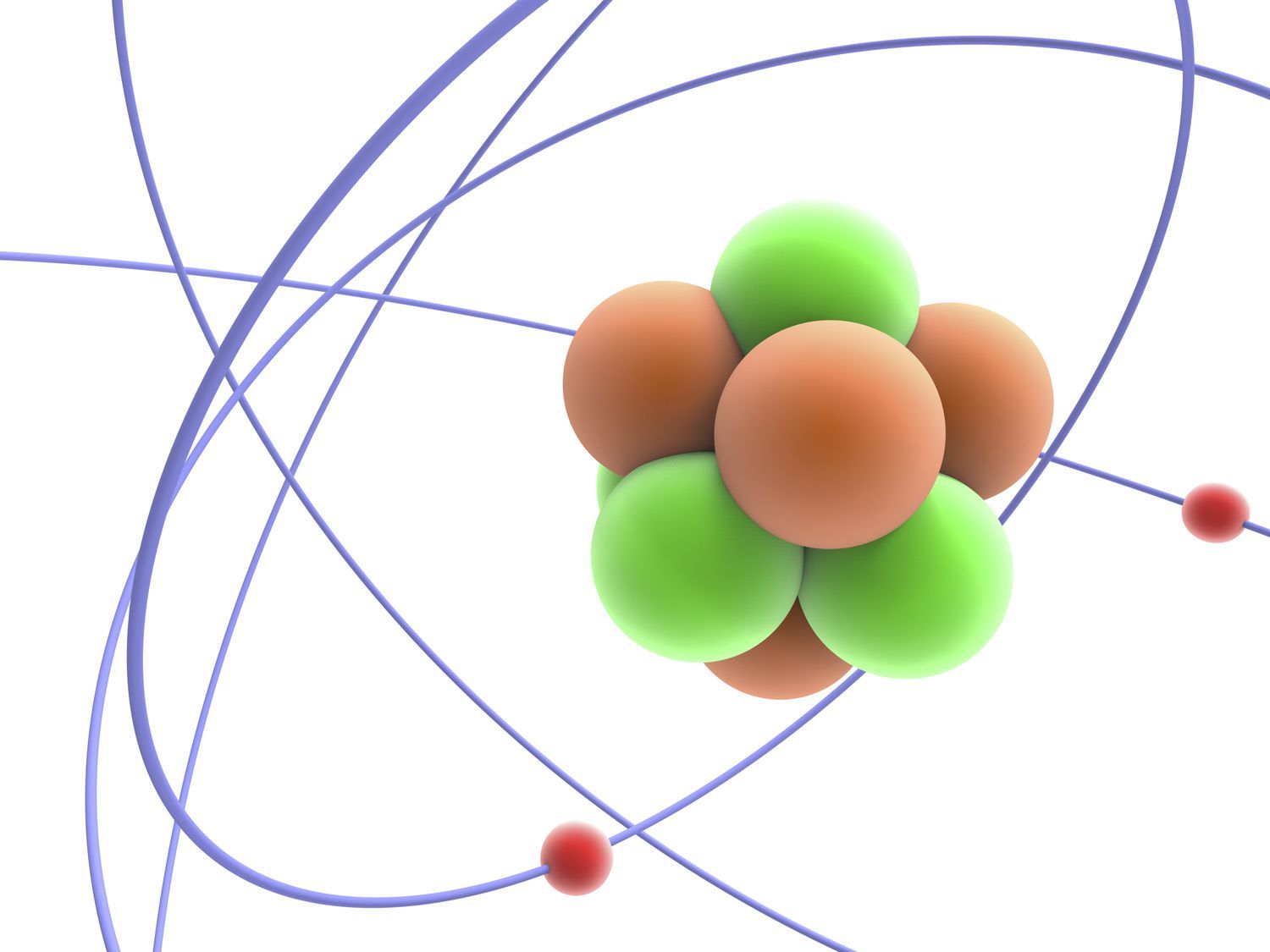
El número atómico de un elemento químico es el número de protones en el núcleo de un átomo del elemento. Es el número de carga del núcleo, ya que los neutrones no llevan carga eléctrica neta. El número atómico determina la identidad de un elemento y muchas de sus propiedades químicas. La tabla periódica moderna se ordena aumentando el número atómico.
Ejemplos de Números Atómicos
El número atómico del hidrógeno es 1; el número atómico del carbono es 6 y el número atómico de la plata es 47: cualquier átomo con 47 protones es un átomo de plata. Variar el número de neutrones en un elemento cambia sus isótopos, mientras que cambiar el número de electrones lo convierte en un ion.
Lectura relacionada: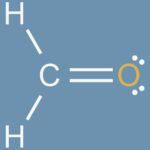 Cómo Dibujar una estructura de Lewis
Cómo Dibujar una estructura de LewisTambién Conocido Como: El número atómico también se conoce como número de protones. Puede estar representado por la letra mayúscula Z. El uso de la letra mayúscula Z proviene de la palabra alemana Atomzahl, que significa " número atómico."Antes del año 1915, la palabra Zahl (número) se usaba para describir la posición de un elemento en la tabla periódica.
Relación entre el Número Atómico y las Propiedades Químicas
La razón por la que el número atómico determina las propiedades químicas de un elemento es que el número de protones también determina el número de electrones en un átomo eléctricamente neutro. Esto, a su vez, define la configuración electrónica del átomo y la naturaleza de su capa más externa o de valencia. El comportamiento de la capa de valencia determina la facilidad con la que un átomo formará enlaces químicos y participará en reacciones químicas.
Lectura relacionada: Elementos fríos en la Tabla Periódica
Elementos fríos en la Tabla Periódica
Nuevos Elementos y Números Atómicos
En el momento de escribir este artículo, se han identificado elementos con números atómicos del 1 al 118. Los científicos suelen hablar de descubrir nuevos elementos con números atómicos más altos. Algunos investigadores creen que puede haber una "isla de estabilidad", donde la configuración de protones y neutrones de átomos superpesados será menos susceptible a la rápida desintegración radiactiva observada en elementos pesados conocidos.
 De Qué Está Hecha la Luna? Composición Química
De Qué Está Hecha la Luna? Composición Química