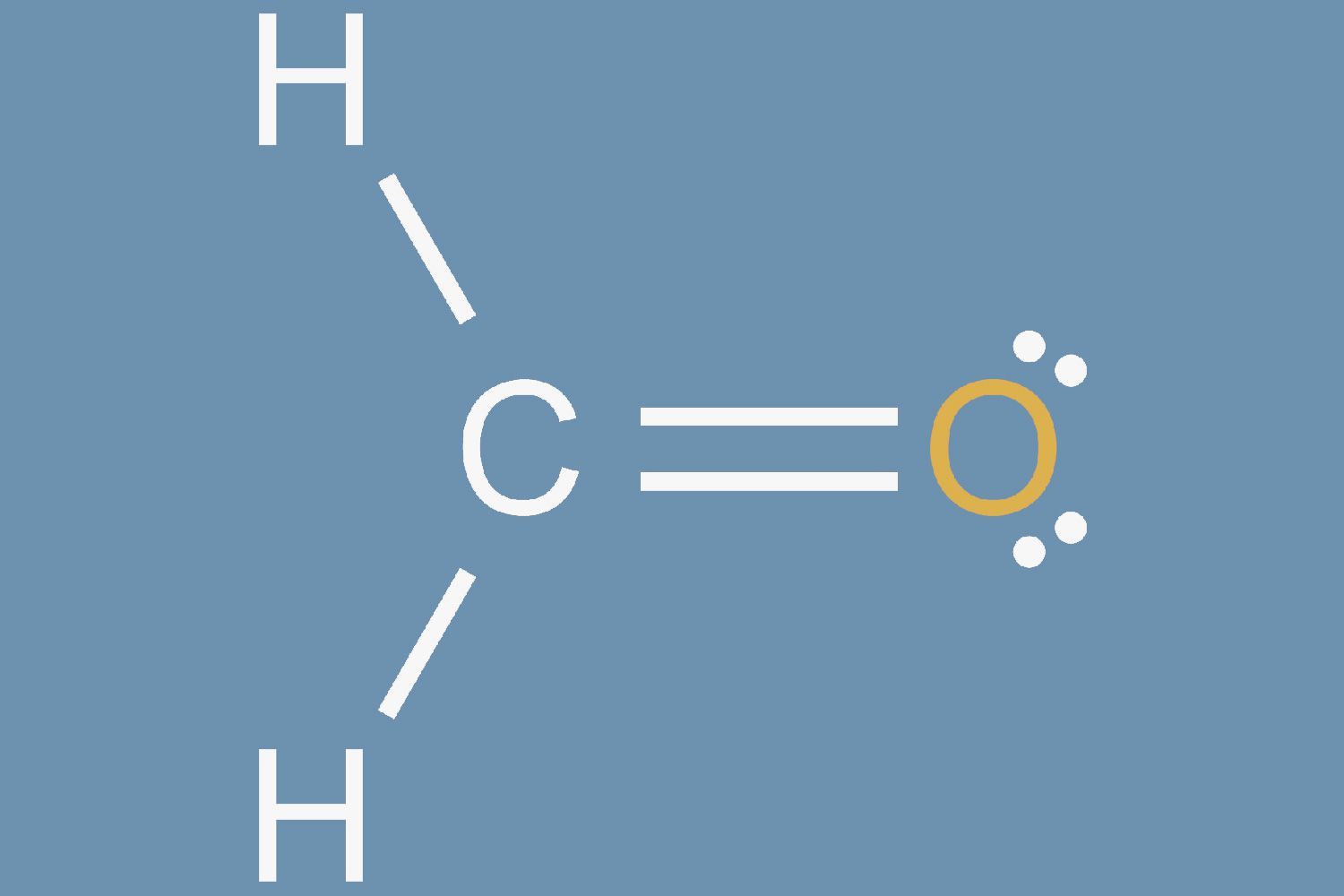
Una estructura de Lewis es una representación gráfica de la distribución de electrones alrededor de los átomos. La razón para aprender a dibujar estructuras de Lewis es predecir el número y el tipo de enlaces que se pueden formar alrededor de un átomo. Una estructura de Lewis también ayuda a hacer una predicción sobre la geometría de una molécula.
Los estudiantes de química a menudo se confunden con los modelos, pero dibujar estructuras de Lewis puede ser un proceso sencillo si se siguen los pasos adecuados. Ten en cuenta que hay varias estrategias diferentes para construir estructuras de Lewis. Estas instrucciones describen la estrategia de Kelter para dibujar estructuras de Lewis para moléculas.
Lectura relacionada:
 Elementos fríos en la Tabla Periódica
Elementos fríos en la Tabla Periódica- Paso 1: Encuentra el Número Total de Electrones de Valencia
- Paso 2: Encuentra la Cantidad de Electrones Necesarios para Hacer que los Átomos sean "Felices"
- Paso 3: Determinar el número de enlaces en la Molécula
- Paso 4: Elige un átomo central
- Paso 5: Dibuja una Estructura Esquelética
- Paso 6: Coloca Electrones Alrededor De Los Átomos Externos
- Paso 7: Coloque los Electrones Restantes Alrededor del Átomo Central
- Estructuras de Lewis Vs. Moléculas Reales
Paso 1: Encuentra el Número Total de Electrones de Valencia
En este paso, suma el número total de electrones de valencia de todos los átomos de la molécula.
Paso 2: Encuentra la Cantidad de Electrones Necesarios para Hacer que los Átomos sean "Felices"
Un átomo se considera "feliz" cuando su capa exterior de electrones está llena. Los elementos hasta el período cuatro en la tabla periódica necesitan ocho electrones para llenar su capa externa de electrones. Esta propiedad se conoce a menudo como la "regla del octeto".
Lectura relacionada: De Qué Está Hecha la Luna? Composición Química
De Qué Está Hecha la Luna? Composición Química
Paso 3: Determinar el número de enlaces en la Molécula
Los enlaces covalentes se forman cuando un electrón de cada átomo forma un par de electrones. El paso 2 indica cuántos electrones se necesitan y el paso 1 es cuántos electrones tiene. Restar el número en el Paso 1 del número en el Paso 2 le da el número de electrones necesarios para completar los octetos. Cada enlace formado requiere dos electrones, por lo que el número de enlaces es la mitad del número de electrones necesarios, o:
(Paso 2-Paso 1)/2
Lectura relacionada: Teoría de Ácidos y Bases de Bronsted Lowry
Teoría de Ácidos y Bases de Bronsted Lowry
Paso 4: Elige un átomo central
El átomo central de una molécula suele ser el átomo menos electronegativo o el átomo con la valencia más alta. Para encontrar la electronegatividad, confíe en las tendencias de la tabla periódica o consulte una tabla que enumere los valores de electronegatividad. La electronegatividad disminuye al moverse hacia abajo en un grupo de la tabla periódica y aumenta al moverse de izquierda a derecha a lo largo de un período. Los átomos de hidrógeno y halógeno tienden a aparecer en el exterior de la molécula y rara vez son el átomo central.
Paso 5: Dibuja una Estructura Esquelética
Conecta los átomos al átomo central con una línea recta que represente un enlace entre los dos átomos. El átomo central puede tener hasta otros cuatro átomos conectados a él.
Paso 6: Coloca Electrones Alrededor De Los Átomos Externos
Completa los octetos alrededor de cada uno de los átomos externos. Si no hay suficientes electrones para completar los octetos, la estructura esquelética de la etapa 5 es incorrecta. Prueba con un arreglo diferente. Inicialmente, esto puede requerir algo de prueba y error. A medida que adquiera experiencia, será más fácil predecir las estructuras esqueléticas.
Paso 7: Coloque los Electrones Restantes Alrededor del Átomo Central
Completa el octeto del átomo central con los electrones restantes. Si quedan enlaces del paso 3, crea dobles enlaces con pares solitarios en átomos externos. Un doble enlace está representado por dos líneas continuas dibujadas entre un par de átomos. Si hay más de ocho electrones en el átomo central y el átomo no es una de las excepciones a la regla del octeto, el número de átomos de valencia en el Paso 1 puede haberse contado incorrectamente. Esto completará la estructura de puntos de Lewis para la molécula.
Estructuras de Lewis Vs. Moléculas Reales
Si bien las estructuras de Lewis son útiles, especialmente cuando está aprendiendo sobre valencia, estados de oxidación y enlaces, hay muchas excepciones a las reglas en el mundo real. Los átomos buscan llenar o llenar hasta la mitad su capa de electrones de valencia. Sin embargo, los átomos pueden formar y forman moléculas que no son idealmente estables. En algunos casos, el átomo central puede formar más que otros átomos conectados a él.
El número de electrones de valencia puede exceder de ocho, especialmente para números atómicos más altos. Las estructuras de Lewis son útiles para elementos ligeros pero menos útiles para metales de transición tales como lantánidos y actínidos. Se advierte a los estudiantes que recuerden que las estructuras de Lewis son una herramienta valiosa para aprender y predecir el comportamiento de los átomos en las moléculas, pero son representaciones imperfectas de la actividad real de los electrones.