Las estructuras de Lewis reciben muchos nombres, incluidas las estructuras de puntos de electrones de Lewis, los diagramas de puntos de Lewis y las estructuras de puntos de electrones. Todos estos nombres se refieren al mismo tipo de diagrama, que pretende mostrar las ubicaciones de los enlaces y los pares de electrones.
Conclusiones clave: Estructura de Lewis
- Una estructura de Lewis es un diagrama que muestra los enlaces covalentes y los pares de electrones solitarios en una molécula.
- Las estructuras de Lewis se basan en la regla del octeto.
- Aunque las estructuras de Lewis son útiles para describir enlaces químicos, están limitadas en que no tienen en cuenta la aromaticidad, ni describen con precisión el comportamiento magnético.
Definición
Una estructura de Lewis es una representación estructural de una molécula donde los puntos se usan para mostrar las posiciones de los electrones alrededor de los átomos y las líneas o pares de puntos representan enlaces covalentes entre átomos. El propósito de dibujar una estructura de puntos de Lewis es identificar los pares de electrones solitarios en las moléculas para ayudar a determinar la formación de enlaces químicos. Se pueden hacer estructuras de Lewis para moléculas que contienen enlaces covalentes y para compuestos de coordinación. La razón es que los electrones se comparten en un enlace covalente. En un enlace iónico, es más como si un átomo donara un electrón al otro átomo.
Lectura relacionada: La Diferencia entre Molalidad y Molaridad
La Diferencia entre Molalidad y Molaridad
Las estructuras de Lewis llevan el nombre de Gilbert N. Lewis, quien introdujo la idea en el artículo "El átomo y la molécula" en 1916.
También Conocido Como: Las estructuras de Lewis también se denominan diagramas de puntos de Lewis, diagramas de puntos de electrones, fórmulas de puntos de Lewis o fórmulas de puntos de electrones. Técnicamente, las estructuras de Lewis y las estructuras de puntos de electrones son diferentes porque las estructuras de puntos de electrones muestran todos los electrones como puntos, mientras que las estructuras de Lewis indican pares compartidos en un enlace químico dibujando una línea.
Lectura relacionada:
 Datos de Vanadio (V o Número atómico 23)
Datos de Vanadio (V o Número atómico 23)Cómo Funciona
Una estructura de Lewis se basa en el concepto de la regla del octeto, en la que los átomos comparten electrones de modo que cada átomo tiene ocho electrones en su capa exterior. Como ejemplo, un átomo de oxígeno tiene seis electrones en su capa exterior. En una estructura de Lewis, estos seis puntos están dispuestos de modo que un átomo tenga dos pares solitarios y dos electrones individuales. Los dos pares estarían opuestos entre sí alrededor del símbolo O y los dos electrones individuales estarían en los otros lados del átomo, opuestos entre sí.
En general, los electrones individuales se escriben en el lado de un símbolo de elemento. Una colocación incorrecta sería (por ejemplo), cuatro electrones en un lado del átomo y dos en el lado opuesto. Cuando el oxígeno se une a dos átomos de hidrógeno para formar agua, cada átomo de hidrógeno tiene un punto para su electrón solitario. La estructura de puntos de electrones para el agua muestra los electrones individuales para el oxígeno que comparten espacio con los electrones individuales del hidrógeno. Los ocho puntos para los puntos alrededor del oxígeno están llenos, por lo que la molécula tiene un octeto estable.
Lectura relacionada:
 ¿Qué Tipo de Enlaces Forma el Carbono?
¿Qué Tipo de Enlaces Forma el Carbono?Cómo Escribir Uno
Para una molécula neutra, siga estos pasos:
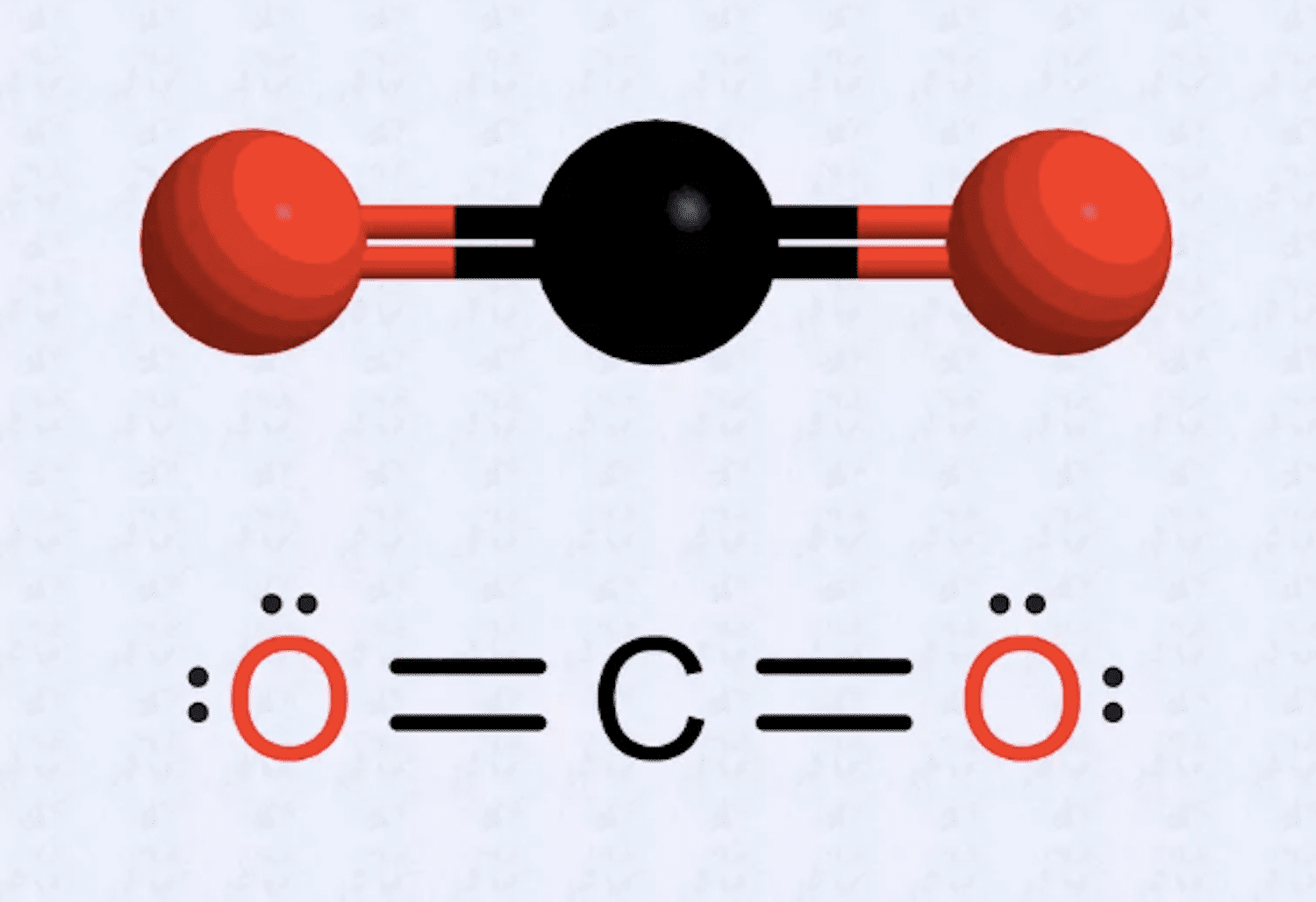
- Determina cuántos electrones de valencia tiene cada átomo de la molécula. Al igual que el dióxido de carbono, cada carbono tiene cuatro electrones de valencia. El oxígeno tiene seis electrones de valencia.
- Si una molécula tiene más de un tipo de átomo, el átomo más metálico o menos electronegativo va en el centro. Si no conoce la electronegatividad, recuerde que la tendencia es que la electronegatividad disminuye a medida que se aleja del flúor en la tabla periódica.
- Organice los electrones de modo que cada átomo contribuya con un electrón para formar un enlace simple entre cada átomo.
- Finalmente, cuenta los electrones alrededor de cada átomo. Si cada uno tiene ocho o un octeto, entonces el octeto está completo. De lo contrario, continúe con el siguiente paso.
- Si tienes un átomo al que le faltan puntos, vuelve a dibujar la estructura para hacer que ciertos electrones formen pares para obtener el número en cada átomo a ocho. Por ejemplo, con dióxido de carbono, la estructura inicial tiene siete electrones asociados con cada átomo de oxígeno y seis electrones para el átomo de carbono. La estructura final pone dos pares (dos conjuntos de dos puntos) en cada átomo de oxígeno, dos puntos de electrones de oxígeno frente al átomo de carbono y dos conjuntos de puntos de carbono (dos electrones en cada lado). Hay cuatro electrones entre cada oxígeno y carbono, que se dibujan como dobles enlaces.