La mayoría de las personas se sienten cómodas con la idea de los enlaces iónicos y covalentes, pero no están seguras de qué son los enlaces de hidrógeno, cómo se forman y por qué son importantes.
Conclusiones Clave: Enlaces de Hidrógeno
- Un enlace de hidrógeno es una atracción entre dos átomos que ya participan en otros enlaces químicos. Uno de los átomos es hidrógeno, mientras que el otro puede ser cualquier átomo electronegativo, como oxígeno, cloro o flúor.
- Se pueden formar enlaces de hidrógeno entre átomos dentro de una molécula o entre dos moléculas separadas.
- Un enlace de hidrógeno es más débil que un enlace iónico o un enlace covalente, pero más fuerte que las fuerzas de van der Waals.
- Los enlaces de hidrógeno juegan un papel importante en la bioquímica y producen muchas de las propiedades únicas del agua.
Definición de Enlace de Hidrógeno
Un enlace de hidrógeno es un tipo de interacción atractiva (dipolo-dipolo) entre un átomo electronegativo y un átomo de hidrógeno unido a otro átomo electronegativo. Este enlace siempre implica un átomo de hidrógeno. Los enlaces de hidrógeno pueden ocurrir entre moléculas o dentro de partes de una sola molécula.
Lectura relacionada: ¿Por qué la Luz y el Calor No Importan? Materia vs Energía
¿Por qué la Luz y el Calor No Importan? Materia vs Energía
Un enlace de hidrógeno tiende a ser más fuerte que las fuerzas de van der Waals, pero más débil que los enlaces covalentes o los enlaces iónicos. Es aproximadamente 1/20 (5%) de la resistencia del enlace covalente formado entre O-H. Sin embargo, incluso este enlace débil es lo suficientemente fuerte como para soportar una ligera fluctuación de temperatura.
Pero los Átomos Ya Están Unidos
¿Cómo se puede atraer el hidrógeno a otro átomo cuando ya está unido? En un enlace polar, un lado del enlace todavía ejerce una ligera carga positiva, mientras que el otro lado tiene una ligera carga eléctrica negativa. La formación de un enlace no neutraliza la naturaleza eléctrica de los átomos participantes.
Lectura relacionada: Obtenga 10 Datos Interesantes Sobre El Oxígeno
Obtenga 10 Datos Interesantes Sobre El Oxígeno
Ejemplos de Enlaces de Hidrógeno
Los enlaces de hidrógeno se encuentran en ácidos nucleicos entre pares de bases y entre moléculas de agua. Este tipo de enlace también se forma entre átomos de hidrógeno y carbono de diferentes moléculas de cloroformo, entre átomos de hidrógeno y nitrógeno de moléculas de amoníaco vecinas, entre subunidades repetidas en el nailon polimérico y entre hidrógeno y oxígeno en acetilacetona. Muchas moléculas orgánicas están sujetas a enlaces de hidrógeno. Enlace de hidrógeno:
- Ayuda a unir los factores de transcripción al ADN
- Ayuda a la unión antígeno-anticuerpo
- Organizar los polipéptidos en estructuras secundarias, como hélice alfa y lámina beta
- Mantenga unidas las dos hebras de ADN
- Unir factores de transcripción entre sí
Lectura relacionada:
 Por qué los Protones y los Neutrones se Pegan en el Núcleo
Por qué los Protones y los Neutrones se Pegan en el NúcleoEnlaces de Hidrógeno en Agua
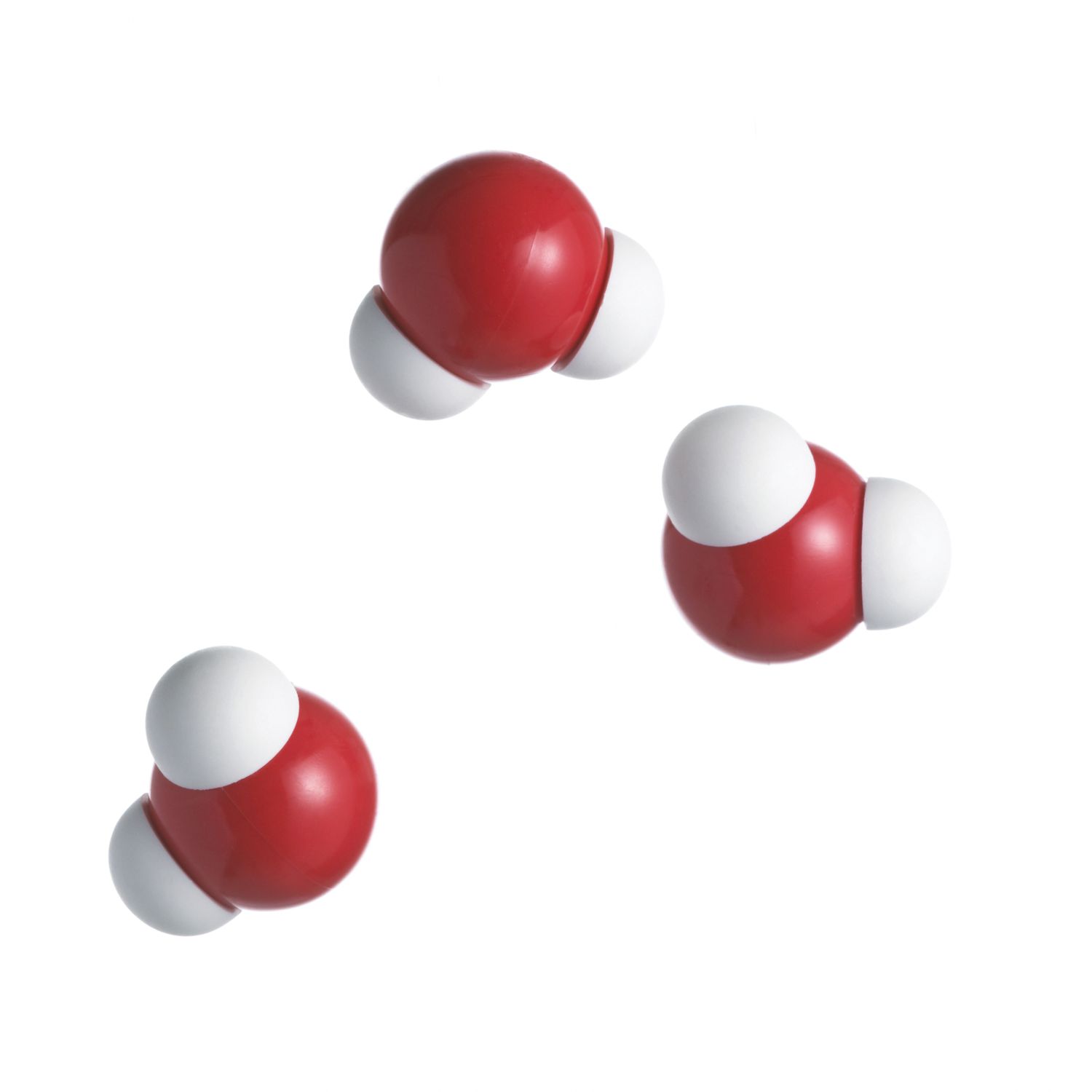
Aunque los enlaces de hidrógeno se forman entre el hidrógeno y cualquier otro átomo electronegativo, los enlaces dentro del agua son los más ubicuos (y algunos dirían, los más importantes). Los enlaces de hidrógeno se forman entre las moléculas de agua vecinas cuando el hidrógeno de un átomo se interpone entre los átomos de oxígeno de su propia molécula y la de su vecino. Esto sucede porque el átomo de hidrógeno es atraído tanto por su propio oxígeno como por otros átomos de oxígeno que se acercan lo suficiente. El núcleo de oxígeno tiene 8 cargas" más", por lo que atrae electrones mejor que el núcleo de hidrógeno, con su única carga positiva. Por lo tanto, las moléculas de oxígeno vecinas son capaces de atraer átomos de hidrógeno de otras moléculas, formando la base de la formación de enlaces de hidrógeno.
El número total de enlaces de hidrógeno formados entre moléculas de agua es 4. Cada molécula de agua puede formar 2 enlaces de hidrógeno entre el oxígeno y los dos átomos de hidrógeno en la molécula. Se pueden formar dos enlaces adicionales entre cada átomo de hidrógeno y los átomos de oxígeno cercanos.
Una consecuencia de los enlaces de hidrógeno es que los enlaces de hidrógeno tienden a disponerse en un tetraedro alrededor de cada molécula de agua, lo que conduce a la estructura cristalina bien conocida de los copos de nieve. En agua líquida, la distancia entre moléculas adyacentes es mayor y la energía de las moléculas es lo suficientemente alta como para que los enlaces de hidrógeno a menudo se estiren y rompan. Sin embargo, incluso las moléculas de agua líquida promedian una disposición tetraédrica. Debido a los enlaces de hidrógeno, la estructura del agua líquida se ordena a una temperatura más baja, mucho más allá de la de otros líquidos. Los enlaces de hidrógeno mantienen las moléculas de agua aproximadamente un 15% más cerca que si los enlaces no estuvieran presentes. Los enlaces son la razón principal por la que el agua muestra propiedades químicas interesantes e inusuales.
- Los enlaces de hidrógeno reducen los cambios extremos de temperatura cerca de grandes masas de agua.
- Los enlaces de hidrógeno permiten que los animales se enfríen usando la transpiración porque se necesita una cantidad tan grande de calor para romper los enlaces de hidrógeno entre las moléculas de agua.
- Los enlaces de hidrógeno mantienen el agua en su estado líquido en un rango de temperatura más amplio que para cualquier otra molécula de tamaño comparable.
- La unión le da al agua un calor de vaporización excepcionalmente alto, lo que significa que se necesita una energía térmica considerable para cambiar el agua líquida en vapor de agua.
Los enlaces de hidrógeno en el agua pesada son incluso más fuertes que los del agua ordinaria elaborados con hidrógeno normal (protio). Los enlaces de hidrógeno en el agua tritiada son aún más fuertes.