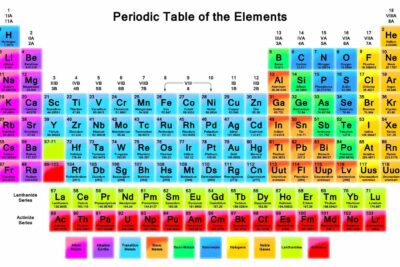
El radón es un elemento radiactivo natural con el símbolo de elemento Rn y número atómico 86. Ubicado en el grupo 18 de los gases nobles, este elemento ocupa una posición única como el número 86 en la tabla periódica. Aquí hay 10 datos sobre el radón que podrían incluso salvarte la vida.
Datos rápidos: Radón
- Nombre del Elemento: Radón
- Símbolo de Elemento: Rn
- Número Atómico: 86
- Grupo de Elementos: Grupo 18 (Gas Noble)
- Período: Período 6, lo que significa que es uno de los elementos del 86 periodo de la tabla periodica.
- Apariencia: Gas incoloro
- El radón es un gas incoloro, inodoro e insípido a temperatura y presión normales. El radón es radiactivo y se descompone en otros elementos radiactivos y tóxicos. El radón se produce en la naturaleza como el producto de desintegración del uranio, el radio, el torio y otros elementos radiactivos. Hay 33 isótopos conocidos de radón. Rn-226 es el más común de estos. Es un emisor alfa con una vida media de 1601 años. Ninguno de los isótopos del radón es estable.
- En la corteza terrestre, el radón se encuentra en una abundancia de 4 x10-13 miligramos por kilogramo. Siempre presente al aire libre y en el agua potable de fuentes naturales, el radón mantiene un nivel bajo en áreas abiertas. Sin embargo, se vuelve problemático en espacios cerrados, como interiores o minas. Es interesante notar que el radón, como elemento 86 de la tabla periodica, desempeña un papel invisible pero significativo en nuestro medio ambiente.
- La EPA de los Estados Unidos estima que la concentración promedio de radón en interiores es de 1.3 picocurios por litro (pCi/L). Aproximadamente 1 de cada 15 hogares en los Estados Unidos tiene niveles altos de radón, que es de 4.0 pCi/L o más. Estos niveles altos de radón se han encontrado en todos los estados de los EE. UU. El radón proviene del suelo, el agua y el suministro de agua. Algunos materiales de construcción también liberan radón, como concreto, encimeras de granito y paneles de pared. La concentración de radón no depende del diseño o la antigüedad de una vivienda, sino de varios factores. Dado que es más pesado que el aire, el gas radón tiende a acumularse en áreas bajas. Los kits de prueba de radón pueden detectar niveles altos de radón, los cuales generalmente se pueden mitigar de manera bastante fácil y económica una vez identificada la amenaza.
- El radón es la segunda causa principal de cáncer de pulmón después del tabaquismo y la principal causa en no fumadores. Se ha relacionado la exposición al radón con la leucemia infantil. El elemento emite partículas alfa, que no pueden penetrar la piel, pero pueden dañar las células si se inhala. A pesar de ser monoatómico, el radón puede penetrar en la mayoría de los materiales y se dispersa fácilmente desde su fuente.
- Los estudios sugieren que los niños pueden tener un mayor riesgo de exposición al radón que los adultos. Esto se debe a que las células de los niños se dividen con más frecuencia, aumentando la probabilidad de daño genético. Además, los niños tienen una tasa metabólica más alta debido a su crecimiento, lo que también aumenta el riesgo.
- El radón, que es el elemento 86 de la tabla periódica, ha recibido otros nombres a lo largo de la historia. Fue descubierto por Fredrich E. Dorn en 1900, quien lo llamó "emanación de radio". Más tarde, William Ramsay y Robert Gray lo aislaron y nombraron niton en 1908. Finalmente, en 1923, se estableció el nombre de radón.
- Como gas noble, el radón tiene una capa externa de electrones estable, lo que lo hace químicamente inerte y monoatómico. No obstante, ha reaccionado con flúor para formar un fluoruro y se conocen clatratos de radón. El radón es uno de los gases más densos y pesados, siendo 9 veces más pesado que el aire.
- A pesar de ser gaseoso e invisible, el radón emite una luminiscencia brillante cuando se enfría por debajo de su punto de congelación (-96 °F o -71 °C), cambiando de color de amarillo a rojo anaranjado a medida que desciende la temperatura.
- El radón ha tenido usos prácticos en el pasado, como el tratamiento del cáncer con radioterapia y como parte de los tratamientos en spas. Hoy en día, su principal uso es como marcador radiactivo para estudiar reacciones químicas superficiales e iniciar reacciones.
- Aunque no es un producto comercial, el radón se puede producir aislando gases de una sal de radio. Después de encender la mezcla de gases para combinar hidrógeno y oxígeno y eliminarlos como agua, y adsorber el dióxido de carbono, el radón se puede separar del nitrógeno congelándolo.
Fuentes
- Haynes, William M., ed. (2011). Manual de Química y Física del CRC (92a ed.). Boca Ratón, Florida: CRC Press. p. 4.122. ISBN 1439855110
- Kusky, Timothy M. (2003). Peligros Geológicos: Un Libro de Consulta. Prensa Greenwood. pp.236-239. ISBN 9781573564694.
```
Lectura relacionada: Grupos Funcionales Comunes en Química Orgánica
Grupos Funcionales Comunes en Química Orgánica