¿Qué es el deuterio? Aquí hay un vistazo a lo que es el deuterio, dónde podría encontrarlo y algunos de los usos del deuterio.
Índice temático
Definición de Deuterio
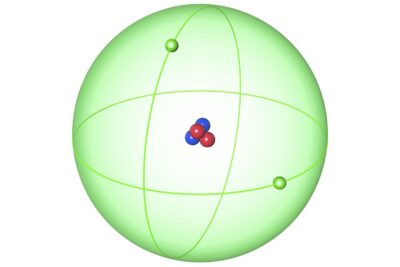
El hidrógeno es único en que tiene tres isótopos que se nombran. El deuterio es uno de los isótopos del hidrógeno. Tiene un protón y un neutrón. En contraste, el isótopo más común de hidrógeno, el protio, tiene un protón y ningún neutrón. Debido a que el deuterio contiene un neutrón, es más masivo o más pesado que el protio, por lo que a veces se le llama hidrógeno pesado. Hay un tercer isótopo de hidrógeno, el tritio, que también se puede llamar hidrógeno pesado porque cada átomo contiene un protón y dos neutrones.
Lectura relacionada: Hechos de Hassio-Hs o Elemento 108
Hechos de Hassio-Hs o Elemento 108
Datos sobre el Deuterio
- El símbolo químico del deuterio es D. A veces el símbolo 2Se usa H.
- El deuterio es un isótopo estable del hidrógeno. En otras palabras, el deuterio es no radiactivo.
- La abundancia natural de deuterio en el océano es de aproximadamente 156,25 ppm, que es un átomo en 6400 de hidrógeno. En otras palabras, el 99,98% del hidrógeno en el océano es protio y solo el 0,0156% es deuterio (o el 0,0312% en masa).
- La abundancia natural de deuterio es ligeramente diferente de una fuente de agua a otra.
- El gas de deuterio es una forma de hidrógeno puro natural. Su fórmula química se escribe como 2H2 o como D2. El gas deuterio puro es raro. Es más común encontrar deuterio unido a un átomo de protio para formar deuteruro de hidrógeno, que se escribe como HD o 1H2H.
- El nombre de deuterio proviene de la palabra griega deuteros, que significa "segundo". Esto es, en referencia a dos, las dos partículas, un protón y un neutrón, que forman el núcleo de un átomo de deuterio.
- Un núcleo de deuterio se denomina deuterón o deuterón.
- El deuterio se utiliza como trazador en reactores de fusión nuclear y para ralentizar los neutrones en reactores de fisión moderados por agua pesada.
- El deuterio fue descubierto en 1931 por Harold Urey. Utilizó la nueva forma de hidrógeno para producir muestras de agua pesada. Urey ganó el Premio Nobel en 1934.
- El deuterio se comporta de manera diferente al hidrógeno normal en las reacciones bioquímicas. Si bien no es mortal beber una pequeña cantidad de agua pesada, por ejemplo, ingerir una gran cantidad puede ser letal.
- El deuterio y el tritio forman enlaces químicos más fuertes que el isótopo protio del hidrógeno. De interés para la farmacología, es más difícil eliminar el carbono del deuterio. El agua pesada es más viscosa que el agua ordinaria y es aproximadamente un 10,6 por ciento más densa.
- El deuterio es uno de los cinco nucleidos estables que tiene un número impar de protones y neutrones. En la mayoría de los átomos, los números impares de protones y neutrones son inestables con respecto a la desintegración beta.
- La presencia de deuterio se ha confirmado en otros planetas del sistema solar y en los espectros de las estrellas. Los planetas exteriores tienen aproximadamente la misma concentración de deuterio entre sí. Se cree que la mayor parte del deuterio presente hoy en día se produjo durante el evento de nucleosíntesis del Big Bang. Muy poco deuterio se ve en el Sol y otras estrellas. El deuterio se consume en las estrellas a un ritmo más rápido de lo que se produce a través de la reacción protón-protón.
- El deuterio se produce separando el agua pesada natural de un gran volumen de agua natural. El deuterio podría producirse en un reactor nuclear, pero el método no es rentable.
Lectura relacionada:
 Espectrometría de Masas: Qué Es y Cómo Funciona
Espectrometría de Masas: Qué Es y Cómo Funciona