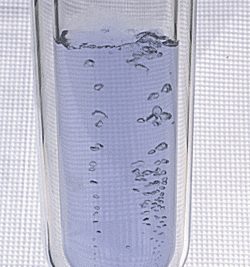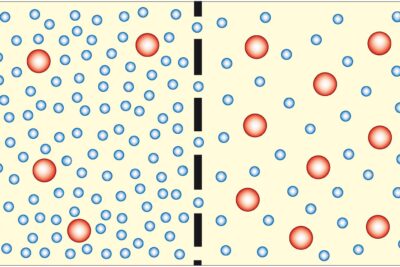
El equilibrio químico es la condición que ocurre cuando la concentración de reactivos y productos que participan en una reacción química no muestra un cambio neto a lo largo del tiempo. El equilibrio químico también puede denominarse "reacción en estado estacionario"."Esto no significa que la reacción química haya dejado de ocurrir necesariamente, sino que el consumo y la formación de sustancias han alcanzado una condición equilibrada. Las cantidades de reactivos y productos han alcanzado una relación constante, pero casi nunca son iguales. Puede haber mucho más producto o mucho más reactivo.
Equilibrio Dinámico
El equilibrio dinámico se produce cuando la reacción química continúa avanzando, pero una serie de productos y reactivos permanecen constantes. Este es un tipo de equilibrio químico.
Lectura relacionada: Cómo Hacer Cristales de Bismuto A Partir De Pepto-Bismol
Cómo Hacer Cristales de Bismuto A Partir De Pepto-Bismol
Escribir la Expresión de Equilibrio
El expresión de equilibrio para una reacción química se puede expresar en términos de la concentración de los productos y reactivos. Solo las especies químicas en las fases acuosa y gaseosa se incluyen en la expresión de equilibrio porque las concentraciones de líquidos y sólidos no cambian. Para la reacción química:
jA + kB → lC + mD
Lectura relacionada: Química Elige Frases para Probar con la Persona que Te Gusta
Química Elige Frases para Probar con la Persona que Te Gusta
La expresión de equilibrio es
K = ([C]l[D]m) / ([A]j[B]k)
K es la constante de equilibrio
[A], [B], [C], [D] etc. son las concentraciones molares de A, B, C, D, etc.
j, k, l, m, etc. son coeficientes en una ecuación química balanceada
 Estructura de Proteínas y Polipéptidos
Estructura de Proteínas y Polipéptidos
Factores Que Afectan El Equilibrio Químico
Primero, considere un factor que no afecta el equilibrio: las sustancias puras. Si un líquido o sólido puro está involucrado en equilibrio, se considera que tiene una constante de equilibrio de 1 y se excluye de la constante de equilibrio. Por ejemplo, excepto en soluciones altamente concentradas, se considera que el agua pura tiene una actividad de 1. Otro ejemplo es el carbono sólido, que puede formarse mediante la reacción de dos moléculas de monóxido de carbono para formar dióxido de carbono y carbono.
Los factores que afectan el equilibrio incluyen:
- La adición de reactivo o producto o un cambio en la concentración afecta el equilibrio. La adición de reactivo puede conducir el equilibrio hacia la derecha en una ecuación química, donde se forma más producto. La adición de producto puede conducir el equilibrio hacia la izquierda, a medida que se forman más reactivos.
- Cambiar la temperatura altera el equilibrio. El aumento de la temperatura siempre desplaza el equilibrio químico en la dirección de la reacción endotérmica. La temperatura decreciente siempre desplaza el equilibrio en la dirección de la reacción exotérmica.
- Cambiar la presión afecta el equilibrio. Por ejemplo, disminuir el volumen de un sistema de gas aumenta su presión, lo que aumenta la concentración de reactivos y productos. La reacción neta verá disminuir la concentración de moléculas de gas.
El principio de Le Chatelier puede usarse para predecir el cambio en el equilibrio resultante de la aplicación de una tensión al sistema. El principio de Le Chatelier establece que un cambio en un sistema en equilibrio causará un cambio predecible en el equilibrio para contrarrestar el cambio. Por ejemplo, la adición de calor a un sistema favorece la dirección de la reacción endotérmica porque esto actuará para reducir la cantidad de calor.