La prueba de la oxidasa es un procedimiento utilizado para determinar la existencia de la enzima citocromo c oxidasa. Lo que hace el sistema es que ayuda al movimiento de electrones entre el colorante redox - tetrametil-p-fenilendiamina y los donantes de electrones de las bacterias.
Ayuda a identificar bacterias capaces de producir citocromo c oxidasa, una enzima presente en la cadena de transporte de electrones bacteriana. Se llama prueba de oxidasa porque si la enzima está presente, la enzima no conducirá a la oxidación del reactivo, produciendo de este modo un producto final de color púrpura (indofenoles).
Lectura relacionada: Pruebas Afectadas por Muestras Hemolizadas, Lipémicas e Ictéricas Y Su Mecanismo
Pruebas Afectadas por Muestras Hemolizadas, Lipémicas e Ictéricas Y Su MecanismoNo hay oxidación si no se encuentra enzima. Por lo tanto, el color del reactivo permanece igual. (1, 2 y 3)
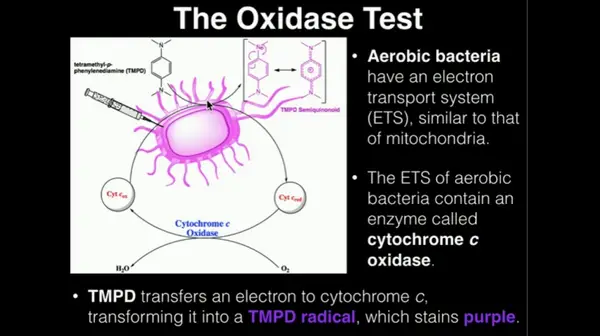
Imagen 1: La imagen muestra un conjunto de bacterias aeróbicas para la prueba de oxidasa.
Fuente de Imagen: ytimg.com
¿Qué hay que tener en cuenta?
Las bacterias que dan positivo en la prueba de oxidasa son aeróbicas. Pueden hacer uso del oxígeno en la respiración. Por otro lado, las bacterias que dan negativo en la prueba de oxidasa pueden ser aeróbicas, anaeróbicas o facultativas.
Lectura relacionada: Transferencia de Southern: Principio, Protocolo (pasos) y Usos
Transferencia de Southern: Principio, Protocolo (pasos) y UsosEsto significa que tales organismos no tienen la enzima citocromo c oxidasa que se necesita para que el reactivo se oxide. (2, 3)
¿Cuáles son los requisitos?
- Papel de filtro húmedo con sustrato
- Disco de papel (preparado comercialmente)
- Alambre de madera o platino
- Reactivos tales como:
- Reactivo de oxidasa de Kovacs
- Reactivo de Gordon y McLeod
- Reactivo Gaby y Hadley (indofenol oxidasa) : (2, 3, 4 y 5)
¿Cuál es el propósito de la prueba de la oxidasa?
- Ayuda a determinar si el organismo tiene una enzima citocromo oxidasa.
- Ayuda a diferenciar ciertas cepas de bacterias como Moraxella, Neisseria, especies de Pasteurella y Campylobacter.
- Ayuda a diferenciar las pseudomonas de otras especies relacionadas. (4, 6)
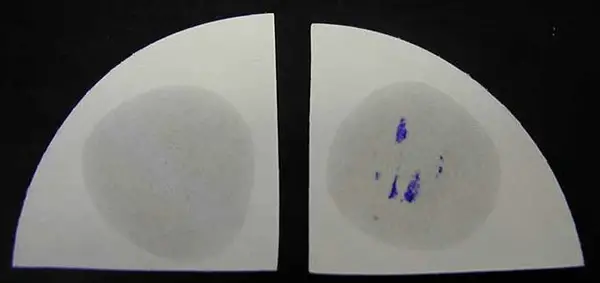
Imagen 2: Método de filtro húmedo ensayo de oxidasa.
Fuente de Imagen: microbiologyinfo.com
 Glucogénesis-Ciclo, Etapas, Importancia (Vs Gluconeogénesis)
Glucogénesis-Ciclo, Etapas, Importancia (Vs Gluconeogénesis)
Imagen 3: Método de filtración en seco ensayo de oxidasa.
Fuente de Imagen: microbiologyinfo.com

Imagen 4: Ensayo de oxidasa por método de placa directa.
Fuente de Imagen: emedicalhub.com
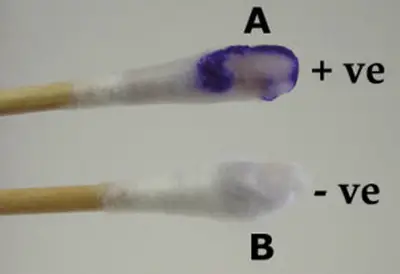
Imagen 5: Método del hisopo ensayo de oxidasa.
Fuente de Imagen: microbiologyinfo.com

Imagen 6: Método de tubo de ensayo ensayo de oxidasa.
Fuente de Imagen: emedicalhub.com
Procedimiento
La prueba de la oxidasa se puede hacer usando diversos métodos. Discutiremos los métodos comúnmente utilizados a continuación.
- Papel de filtro seco - Este es el método más conveniente. Los procedimientos son los siguientes::
- Remoje el papel de filtro (Whatman # 1) en una solución de diclorhidrato de tertrametil-p-fenileno-diamina al 1%.
- Escurrir durante aproximadamente medio minuto.
- Congele el papel de filtro y guárdelo en una botella; preferiblemente la oscura y con una tapa asegurada con tornillos.
- Si se usa, es imprescindible retirar la tira, usar agua destilada para humedecer la tira y colocarla en la placa de Petri.
- Usando el lazo (platino), recoja la colonia y frote sobre la sección húmeda.
- Papel de Filtro Húmedo – Se llama método de papel de filtro húmedo porque el filtro se empapa en una solución al 1% del reactivo. Usando un lazo (hecho de material de platino), frote el cultivo en el papel de filtro.
- Placa Directa - Añadir un reactivo; idealmente de dos a tres gotas a las colonias sospechosas en la placa de agar. Simplemente agregue suficiente reactivo, ya que poner demasiado reactivo puede alterar el resultado. Esté atento a cualquier cambio de color en un lapso de 10 segundos. Este tipo de prueba de oxidasa debe realizarse en la placa de agar (no selectiva).
- Método del hisopo – el hisopo debe sumergirse en el reactivo y debe estar en contacto con la colonia aislada sospechosa. Ten cuidado con los cambios de color en 10 segundos.
- Tubo de ensayo - El cultivo de bacterias frescas se hace crecer en un caldo nutritivo (4,5 ml). El cultivo debe realizarse en un plazo de 18 a 24 horas. Añadir Gaby y reactivo de Hadley (0,2 ml). Agite el tubo de ensayo para asegurarse de que la mezcla esté bien mezclada y que el cultivo tenga una oxigenación completa. Ten cuidado con los cambios de color. (4, 7, 8, 9 y 10)
Interpretación de Resultados
- Positivo: El resultado es positivo si nota un intenso tono púrpura intenso en 10 segundos.
- Positivo retardado: si el tono púrpura intenso apareció en 60 segundos.
- Negativo: el resultado es negativo si el color no cambió en absoluto o si cambia después de 60 segundos. (1, 3 y 8)
Nota al usar los reactivos
- Reactivo de oxidasa de Kovac – Cuando se usa este reactivo, los organismos que se están probando resultarían positivos si el color del medio cambia a púrpura oscuro en 10 segundos. Se observa una prueba positiva retrasada si el color cambia a púrpura oscuro en 60 a 90 segundos. Por otro lado, la prueba es negativa si no se produjeron cambios de color después de dos minutos.
- Reactivo de Gordon y McLeod – Los organismos que se están analizando son positivos para la prueba de oxidasa si el color se vuelve rojo en 10 a 30 minutos o si cambia a negro en 60 minutos. Si no hay cambios después de ese período de tiempo dado, entonces la prueba es negativa. (2, 4, 9 y 10)
Ejemplos de bacterias que dan positivo para la prueba de oxidasa
- Neisseria
- Pseudomonas
- Vibrio cholerae
- Campylobacter spp
- Aeromonas spp
- Helicobacter spp/ Haemophilus spp
- Alcalígenos
- Brucella
- Moraxella
- Pasteurella
- Legionella pneumophila (4, 5)
Ejemplos de organismos que dan negativo en la prueba de oxidasa
- Familia de las enterobacterias
¿Hay alguna limitación?
- Al realizar la prueba, existe la posibilidad de que el reactivo se autooxide. Por lo tanto, es de suma importancia usar solo reactivos frescos. Para que el reactivo se considere fresco, no debe durar más de una semana.
- Es importante verificar las colonias en los medios que no contienen azúcar en exceso, como el agar nutritivo y el agar de soja tríptico. Una alta concentración de glucosa en los medios conduce a un resultado falso positivo.
- El resultado puede ser aberrante si el microorganismo que se está ensayando se cultiva en los medios que contienen colorantes.
- Realizar un subcultivo antes de añadir el reactivo al cultivo activo, ya que algunos reactivos pueden destruir los microorganismos.
- La prueba de oxidasa es útil para identificar Neisseria, así como para identificar y diferenciar bacilos gramnegativos. Para averiguar la reacción de Gram y la morfología del organismo que se está probando, se debe verificar usando tinción de Gram.
- Siempre use bucles de platino. El uso de bucles que contienen hierro puede dar lugar a un resultado falso positivo.
- Es posible un resultado falso negativo si el reactivo o las tiras utilizadas son menos sensibles.
- Asegúrese de que las colonias utilizadas para la prueba de oxidasa tengan de 18 a 24 horas de edad. Si va a usar colonias más viejas, provocará una reacción débil. (3, 9 y 10)
Referencia
- https://en.wikipedia.org/wiki/Oxidase_test
- https://microbeonline.com/oxidase-test-principle-procedure-and-oxidase-positive-organisms/
- https://microbiologyinfo.com/oxidase-test-principle-uses-procedure-types-result-interpretation-examples-and-limitations/
- http://www.asmscience.org/content/education/protocol/protocol.3229
- http://delrio.dcccd.edu/jreynolds/microbiology/2421/lab_manual/oxidase.pdf
- http://www.vumicro.com/vumie/help/VUMICRO/Oxidase_Test.htm
- http://spot.pcc.edu/~jvolpe/b/bi234/lab/differentialTests/oxidase_test.htm
- https://www.microbiologyresearch.org/docserver/fulltext/ijsem/26/2/ijs-26-2-127.pdf?expires=1550857562&id=id&accname=guest&checksum=30FBEEC026731A26657033D0F6D09934
- http://www.biologypractical.com/oxidase-test-principle-procedure-result-interpretation-precautions/
- https://microbenotes.com/oxidase-test-principle-procedure-and-results/