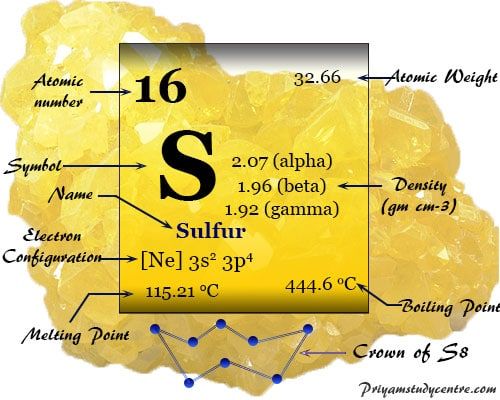
Datos sobre el elemento Azufre
Azufre es el elemento químico no metálico del grupo 16 o VIA (familia Chalgens) de la tabla periódica con símbolo s y número atómico 16. Es ampliamente utilizado para la producción de ácido sulfúrico en la industria química.
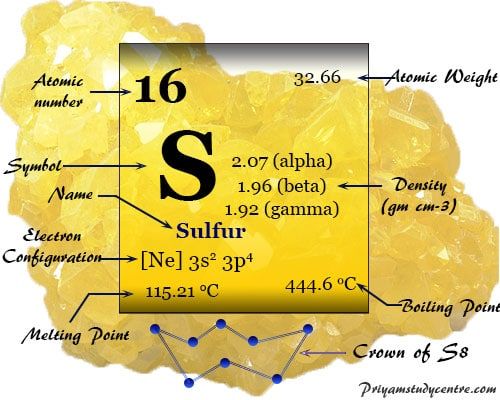
El azufre puro es de color amarillo pálido, insípido, desordenado, sólido quebradizo, pobre conductor eléctrico e insoluble en agua. Forma una gran cantidad de alótropos con anillos fruncidos o átomos de azufre de cadena larga.
Lectura relacionada: Cobre, Hechos, Símbolo, Propiedades, Conexiones, Uso
Cobre, Hechos, Símbolo, Propiedades, Conexiones, UsoEn química, excepto el oro y el platino, reacciona con la mayoría de los elementos para formar una gran cantidad de compuestos químicos metálicos y no metálicos.
Propiedades del azufre
La capa cuántica exterior consta de una s2pags4 configuración electrónica con un orbital d vacío. Debido a la presencia del orbital d vacío, muestra diferentes números de oxidación o estados en diferentes tipos de compuestos químicos. Los estados de oxidación más comunes son −2, +4 y +6.
Algunas propiedades físicas y atómicas del azufre se dan debajo de la tabla,
Lectura relacionada: Fluor, Símbolo, Descubrimiento, Propiedades, Uso, Hechos
Fluor, Símbolo, Descubrimiento, Propiedades, Uso, Hechos| Azufre |
|||
| Símbolo | s | ||
| Descubrimiento | prehistórico | ||
| Nombre derivado de | La palabra sánscrita sulvere o la palabra latina sulfurium | ||
| alótropos | α-S (ortorrómbica), β-S (monoclínica), S2s3ciclo-S8 | ||
| isótopos comunes | dieciséiss32 | ||
| Estados del número de oxidación | +6+4, +2, −2 | ||
| número CAS | 7704-34-9 | ||
| Propiedades periódicas | |||
| número atómico | dieciséis | ||
| Peso atomico | 32.06 | ||
| electrón por celda | 2, 8, 6 | ||
| Configuración electrónica del azufre | [Ne] 3s2 3p4 | ||
| Bloquear | bloque p | ||
| Grupo | dieciséis | ||
| Período de tiempo | 3 | ||
| Características físicas | |||
| Condición a 20 °C | firma | ||
| Punto de fusion | 115,21 °C, 239,38 °F, 388,36 K | ||
| Punto de ebullición | 444,61 °C, 832,30 °F, 717,76 K | ||
| Capacidad calorífica molar | 22,75 J mol−1 k1 | ||
| estructura cristalina | ortorrómbico | ||
| Espesor | 2,07 g/cm23 | ||
| Propiedades atómicas | |||
| Radio atómico (sin consolidar) | 1.80 | ||
| Radio covalente | 1.04 | ||
| Electronegatividad | 2,58 (escala de Pauling) | ||
| Afinidad electronica | 200,41 kJ mol−1 | ||
| Energía de ionización (kJ/mol) | 1º | 2do | 3ro |
| 999.59 | 2251.76 | 3356.72 | |
Azufre en la tabla periódica
El azufre se coloca en el grupo 16 (VIB) de la tabla periódica. Es el miembro del grupo del grupo de oxígeno, selenio, telurio y polonio. Se les llama colectivamente calcógenos.
 Nitrogeno, descubrimiento, producción, uso y fijación.
Nitrogeno, descubrimiento, producción, uso y fijación.En 1809, los químicos franceses Louis-Joseph Gay-Lussac y Louis-Jacques Thénard sugirieron la presencia de azufre en la naturaleza. Tiene cuatro isótopos estables, 32S, 33S, 34Arena 36s.
Propiedades químicas
La capa cuántica exterior consta de una s2pags4 estructura electrónica con un orbital d vacío. El elemento puede usar sus orbitales d vacíos para fines de enlace químico, dando las valencias 2, 4 y 6.
El elemento está a solo dos electrones de la siguiente configuración de gas noble que generalmente se puede lograr formando un enlace covalente.
¿Por qué el azufre es un no metal?
La energía de ionización es generalmente alta y decrece en el grupo de la tabla del período. La tendencia normal del carácter metálico aumenta con el aumento del número atómico.
Por lo tanto, bajo la familia del grupo 16, el oxígeno y el azufre son no metales, el selenio y el telurio son metaloides o semiconductores, y el polonio es un metal.
¿Dónde se encuentra el azufre?
Es el décimo elemento químico más abundante en el universo de la Tierra, que se conoce desde la historia antigua. El azufre se encuentra en muchos minerales comunes como el yeso (CaSO42H2O), galena (PbS), pirita (FeS2) y cinabrio (HgS).
También se presenta como sulfuro de hidrógeno en gas natural, petróleo y compuestos orgánicos de azufre en el carbón.
El azufre nativo se encuentra en muchos lugares de la tierra y en muchos compuestos orgánicos como el pelo, la lana, la clara de huevo, el ajo, la cebolla y la mostaza.
Proceso de producción
Hoy en día, casi el 25 por ciento del elemento se produce a partir de gas natural, petróleo y minerales que contienen azufre. Por lo general, se extrae de depósitos subterráneos mediante el proceso Frasch.
Tres tubos concéntricos están hundidos en la capa de azufre de la tierra (150 a 200 metros debajo de la superficie). El elemento es derretido por agua sobrecalentada y empujado hacia arriba por el compresor de aire para la extracción del elemento.
Los minerales de sulfato como el yeso se tratan con carbono para producir sulfuro de metal. El sulfuro de metal reacciona con el ácido para formar sulfuro de hidrógeno que convierte el azufre a través del proceso de autorreducción.
Refinería de gas natural
Recientemente, se ha extraído una gran cantidad de azufre mediante el proceso de refinación de gas natural que contiene de 15 a 20 por ciento de sulfuro de hidrógeno. El sulfuro de hidrógeno absorbido en la monoetanolamina sigue a la oxidación parcial.
El elemento se produce por autorreducción entre H2S y SO2 por encima de Fe2O3/Ya2O3 catalizador químico a 300°C.
Eliminación de azufre del petróleo crudo
Un millón de toneladas del elemento se encuentra en los Estados Unidos y Japón, que se recupera de la eliminación de azufre del petróleo crudo. Se puede eliminar del petróleo crudo tratándolo con una solución alcalina de plomo sódico para reducir la contaminación del aire.
Alótropos de azufre
El alótropo contiene un anillo estacionado de 6 a 20 átomos. El alótropo difiere prácticamente en diferentes tipos de unidades de empaquetamiento y repulsión variable entre pares de electrones solitarios en átomos vecinos.
El ciclohexasulfuro y la ciclooctasafur contienen anillos fruncidos no planificados.
¿Qué es el azufre en forma de diamante?
La forma más común de azufre es el ortorrómbico (S) con la S8 anillo en formación de corona. A 95,5 C cambia lentamente a forma monoclínica (S) con la S8 anillo pero en diferentes envases.
¿Qué es el Azufre Monoclínico?
La forma monoclínica se obtiene por cristalización del azufre fundido a unos 100 °C seguido de un enfriamiento rápido a temperatura ambiente.
Una tercera variedad sólida cristalina, la forma γ-monoclínica se obtiene a partir de soluciones concentradas calientes de azufre en CS2 o alcohol etílico o enfriando lentamente el elemento fundido a aproximadamente 150°C.
El ciclo S6 Este tipo, también llamado azufre de Engel, fue preparado por Engel en 1891 añadiendo ácido clorhídrico a una solución saturada de tiosulfato de sodio a 0 °C.
Las especies de cadena se denominan colectivamente catena-S y están disponibles en formas altamente metaestables, como gomosa, plástica, laminar, fibrosa, etc.
El azufre líquido (punto de fusión 115 °C) se compone casi en su totalidad de S8 molécula.
Viscosidad del azufre con la temperatura
La viscosidad del líquido amarillo transparente primero disminuye al aumentar la temperatura, pero después de 159 °C, la viscosidad aumenta abruptamente para alcanzar el máximo. Luego caer suavemente hasta el punto de ebullición.
Los cambios se deben a la ruptura de S8 anillos a dirradicales con electrones desapareados en átomos S terminales.
compuestos de azufre
Se combina con la mayoría de los elementos de la tabla periódica para formar muchos compuestos en los estados de oxidación −2, +4 y +6. Es el segundo elemento después del carbono que exhibe propiedades de catenación debido a la formación de anillos o cadenas.
Hidruro, sulfuros, óxidos, oxoácidos y sales son los ejemplos más comunes de compuestos de azufre.
sulfuro de hidrógeno
El sulfuro de hidrógeno o hidrógeno sulfurado es el hidruro de azufre más conocido formado por una combinación directa del elemento con hidrógeno.
En la eliminación de azufre del petróleo se obtiene una gran cantidad de sulfuro de hidrógeno. Es ampliamente utilizado como agente reductor en laboratorios químicos.
El agua formada por oxígeno del elemento del grupo 16 es un líquido debido a la existencia de enlaces de hidrógeno, pero el sulfuro de hidrógeno es un gas debido a la ausencia de dicho enlace. Tiene un olor característico a huevos podridos.
sulfuros de metal
Todos los metales (excepto el oro y el platino) reaccionan con S para formar sulfuros metálicos. Estos son los compuestos iónicos que contienen iones de sulfuro cargados negativamente (S−2). El sulfuro de hierro, níquel, cobre, cobalto y zinc son los minerales importantes de los respectivos metales.
Óxidos de azufre
ASI QUE2 y por lo tanto3 son los principales óxidos de azufre que se preparan calentando el elemento con aire u oxígeno. Los óxidos son solubles en agua para dar sulfúrico y ácido sulfúrico.
El ácido sulfúrico es un químico importante y un importante contaminante que causa la contaminación del aire, la contaminación del suelo o la lluvia ácida en el medio ambiente terrestre.
otras conexiones
Reacciona con flúor para formar hexafluoruro de azufre (SF6) que se utiliza como aislante en el aparato eléctrico. Es un componente importante de las plantas y los animales.
Muchas proteínas y aminoácidos como la cisteína, la cistina y la metionina contienen un átomo de S. Implica muchas reacciones metabólicas importantes del organismo vivo.
uso de azufre
- Se utiliza ampliamente (88 por ciento del uso total) en la fabricación de ácido sulfúrico, el químico más importante en la industria y el estado de la economía nacional.
- Otras aplicaciones importantes del azufre incluyen la vulcanización del caucho y la producción de disulfuro de carbono (CS2).
- También se usa para hacer rayón, medicinas, insecticidas y fungicidas.
- Ácido sulfúrico y SO2 son agentes blanqueadores esenciales en la industria azucarera y papelera.
- El ácido sulfúrico obtenido a partir del azufre o sus compuestos se utiliza en gran medida para fabricar fertilizantes de fosfato y sulfato de amonio.
- El ácido sulfúrico obtenido del azufre también se utiliza para fabricar detergentes, pinturas, pigmentos, rayón, derivados del petróleo, láminas de metal, baterías, materiales explosivos y otros diversos tipos de productos.