
Berilio
Berilio es un elemento químico o metal alcalinotérreo del Grupo 2 (IIA) de la tabla periódica con el símbolo Be y número atómico 4. Se utiliza mucho en metalurgia para mejorar las propiedades de las aleaciones de cobre y níquel.

Es el primer miembro de los metales alcalinotérreos con un tamaño muy pequeño y una carga nuclear muy alta.
Lectura relacionada: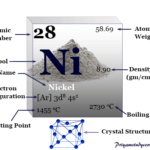 Niquel, Símbolo, Propiedades, Producción, Hechos, Uso
Niquel, Símbolo, Propiedades, Producción, Hechos, UsoFue descubierto a partir del mineral berilo en 1798 (Vauquelin), pero su peso atómico fue determinado mucho más tarde por Mendeleev. Fue preparado de forma independiente por Wohler y Bussy en 1828 mediante la reducción de BeCl3 con potasio
Propiedades del berilio
Forma una red cristalina empaquetada cerrada hexagonal (HCP). Muestra un número o estado de oxidación dipositivo debido a la liberación o el intercambio de dos electrones de valencia.
La primera energía de ionización es más bien baja que la segunda energía de ionización del átomo de berilio.
Lectura relacionada: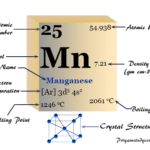 manganeso, Símbolo, Propiedades, Conexiones, Uso
manganeso, Símbolo, Propiedades, Conexiones, Uso| Berilio | |||
| Símbolo | Ser - estar | ||
| Descubrimiento | Nicolás Louis Vauquelin en 1797 | ||
| Nombre derivado de | La palabra griega para berilo significa beryllo | ||
| isótopo común | 2Ser - estar9 | ||
| Estados de oxidación | 0, +1, +2 | ||
| número CAS | 7440-41-7 | ||
| Propiedades periódicas | |||
| número atómico | 4 | ||
| Masa atómica relativa | 9,012 | ||
| electrón por celda | 2, 2 | ||
| Configuración electrónica | [He] 2s2 | ||
| Bloquear | bloque s | ||
| Grupo | 2 | ||
| Período de tiempo | 2 | ||
| Características físicas | |||
| Condición a 20 °C | firma | ||
| Punto de fusion | 1287°C, 2349°F, 1560K | ||
| Punto de ebullición | 2468°C, 4474°F, 2741K | ||
| Capacidad calorífica molar | 16.443 J mol−1 k1 | ||
| estructura cristalina | empaquetado herméticamente hexagonal (hcp) | ||
| Espesor | 1,85 g/cm23 | ||
| Resistencia eléctrica | 36nm | ||
| Propiedades atómicas | |||
| Radio atómico (sin consolidar) | 1.53 | ||
| Radio covalente | 0,99 € | ||
| Electronegatividad | 1,57 (escala de Pauling) | ||
| Afinidad electronica | desconocido | ||
| Energía de ionización (kJ/mol) | 1º | 2do | 3ro |
| 899.50 | 1757.11 | 14848.77 | |
Berilio en la tabla periódica
El berilio se coloca en el período 2 y el grupo 2 de la tabla periódica. Es un elemento s-block que se encuentra con magnesio y calcio.
 Cromo, Hechos, Propiedades, Conexiones, Uso
Cromo, Hechos, Propiedades, Conexiones, Uso¿Dónde se encuentra el berilio?
La concentración de berilio es muy baja (2 a 6 ppm) en la corteza terrestre. La pequeña abundancia de berilio se debe a la transmutación del átomo de Be bajo el bombardeo natural de protones.
El elemento es fácilmente accesible a través de minerales como Beryl (Be3Ya2Si6O18) y Fenacita (Be2SiO4). También se encuentra en las rocas de pegmatita y forma grandes y hermosos sólidos cristalinos que se utilizan como piedras preciosas, como la esmeralda (color verde) o la aguamarina (color azul verdoso).
Proceso de producción
- El mineral berilo se tostó con fluoruro de sodio y Na2SiF6 a 700 °C a 750 °C para obtener Na insoluble. Dar forma3alF6 y Na soluble2Antes4.
- La masa tostada se lixivia con agua hirviendo para formar una solución de fluoberilato de sodio.
- El extracto se precipita como Be(OH)2 por hidróxido de sodio en una escala de pH de 12.
- El precipitado reacciona con NH4AF2 para formar fluoroberilato de amonio y se calienta a 900°C para formar BeF. Dar forma2.
- El metal berilio se produce por la reducción de BeF2 con magnesio a 1300°C.
Propiedades químicas del berilio
berilio (4Ser - estar8) tiene número atómico 4 y número de masa 8. Por lo tanto, el núcleo de Be contiene 4 protones y 4 neutrones rodeados por cuatro partículas de electrones.
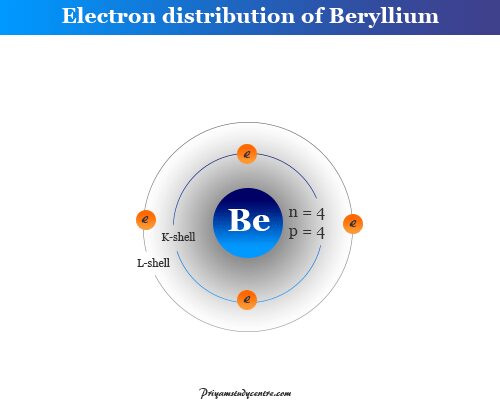
Todos los elementos del grupo 2, como el berilio, el magnesio, el calcio, el estroncio, el bario y el radio, se caracterizan por tener dos electrones de valencia en la capa s más externa. Estos dos electrones siempre están involucrados juntos en la formación de enlaces químicos en química.
Los puntos de fusión de los metales alcalinotérreos son significativamente más altos que los de los metales alcalinos debido a la variación en la estructura cristalina.
Hemos visto que el berilio es mucho menos reactivo que los demás elementos del grupo debido a su pequeño tamaño. Se disuelve en ácidos minerales acuosos como el ácido clorhídrico, el ácido sulfúrico y el ácido nítrico para liberar gas hidrógeno.
Datos interesantes sobre el berilio
La relación de carga por haz para Be+2 es muy alto, mayor que el de todos los cationes excepto H+ y B+3. El valor más cercano se encuentra con Al+3. Este hecho sugiere que el berilio y el aluminio tienen propiedades físicas y químicas similares.
- Ambos metales se disuelven en álcali acuoso generando hidrógeno.
- Los potenciales de electrodo estándar de los dos metales son iguales (-1,7 V).
- Los óxidos e hidróxidos son anfóteros y los haluros anhidros de ambos metales se forman en compuestos diméricos con puentes metal-halógeno-metal.
- La estabilidad térmica de ambos sulfatos metálicos es casi la misma.
Ingredientes químicos
Hidruros, óxidos e hidróxido de berilio
No forma hidruros directamente sino BeH2 se puede obtener por BeCl. disminuir2 con hidruro de litio con LiAlH4. El hidruro de berilio es un sólido blanco amorfo que se descompone por encima de los 250°C para dar hidrógeno.
Forma su monóxido (BeO) cuando se calienta a oxígeno. El óxido de berilio es de naturaleza fuertemente básica y se forma por enlace covalente.
El hidróxido como Be(OH)2 se puede obtener tratando su monoóxido con agua o agregando álcali a una solución acuosa de las sales.
Carburos, nitruros y haluros de berilio
El carburo de Be tiene la fórmula química Be2C. Se forma por reacción directa con carbón a 1900 ° C. También se obtiene calentando metal con acetileno a unos 400 ° C.
Se quema en nitrógeno para formar nitruros sólidos cristalinos como Be3norte2.
Todos los metales del grupo 2 se combinan con halógeno a una temperatura apropiada para formar dihaluros como BeCl. Dar forma2 o MgCl2. Todos los haluros de berilio son de naturaleza covalente y polimérica. No conducen electricidad en la fase fundida del metal.
Compuestos organometálicos
Los alquilos de berilio se pueden hacer mediante una reacción,
HgMe2 + Be → Hg + BeMe2 a 110°C
Los compuestos de arilo del metal se obtienen haciendo reaccionar arilo de litio (en un hidrocarburo) con BeCl2 en éter Estos compuestos son líquidos o sólidos viscosos que se inflaman espontáneamente en el aire y se hidrolizan rápidamente por una molécula de agua.
Usos del berilio
El berilio se usa ampliamente para mejorar las propiedades de los metales de transición como el cobre y el níquel. Alrededor del dos por ciento de Be aumenta la fuerza de Cu seis veces.
Las aleaciones de berilio no son magnéticas, son resistentes a la corrosión y tienen alta resistencia y buena conductividad eléctrica. Encuentran amplias aplicaciones en partes móviles críticas de las industrias aeroespacial o eléctrica, como aviones de alta velocidad, misiles guiados, naves espaciales, satélites y toberas de cohetes de combustible líquido.
El metal berilio también se utiliza en plantas de energía nuclear como moderador y como material de ventana para espectro electromagnético o tubos de rayos X.












