¿Qué es el aluminio metálico?
El Aluminio (símbolo Al) es un elemento químico o metal blando de color blanco plateado, brillante, de bajo punto de fusión, del grupo 13 (IIIA) o familia del boro de la tabla periódica muy utilizado en nuestra vida diaria. El aluminio es el tercer elemento químico más abundante después del oxígeno y el silicio.
Es el elemento metálico más abundante en la corteza terrestre (8% en peso).
Lectura relacionada: Titanio, Símbolo, Propiedades, Hechos, Conexiones, Uso
Titanio, Símbolo, Propiedades, Hechos, Conexiones, UsoAl difiere del primer miembro del Grupo 13 (boro) por sus propiedades químicas, alta reactividad y química catiónica en una solución acuosa.
Combina la mayoría de los elementos no metálicos como nitrógeno, azufre y halógenos. Forma compuestos intermetálicos de aluminio con una gran cantidad de metales.
Propiedades del aluminio
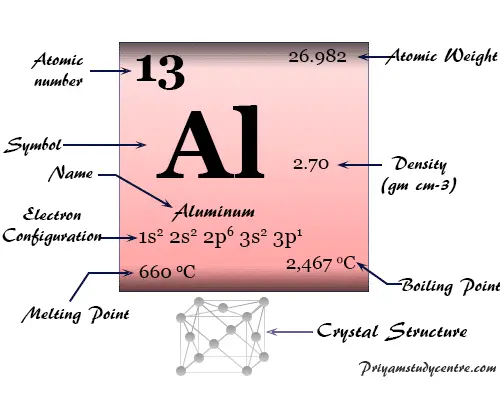
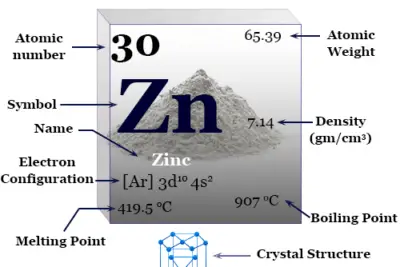
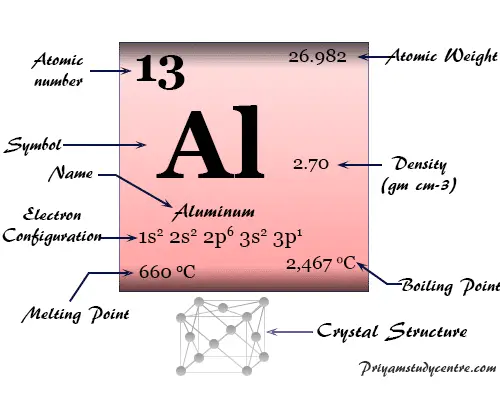
Red cristalina cúbica centrada en las caras (fcc), el aluminio tiene el símbolo químico Al, número atómico 13. El nombre aluminio proviene de la palabra latina alumen, que describe el sulfato de potasio y aluminio, KAl(SO4)212H2o
Lectura relacionada: Oro, Hechos, Uso, Propiedades, Procesamiento
Oro, Hechos, Uso, Propiedades, Procesamiento| Aluminio | |||
| Símbolo | Ya | ||
| Descubrimiento | Hans Oersted en 1825 | ||
| Nombre derivado de | La palabra latina para alum alumen significa sal amarga | ||
| isótopo común | 13Ya27 | ||
| Estados de oxidación | −2, −1, +1, +2, +3 | ||
| número CAS | 7429-90-5 | ||
| Propiedades periódicas | |||
| número atómico | 13 | ||
| Masa atómica relativa | 26.982 | ||
| electrón por celda | 2, 8, 3 | ||
| Configuración electrónica | [Ne] 3s2 3p1 | ||
| Bloquear | bloque p | ||
| Grupo | 13 | ||
| Período de tiempo | 3 | ||
| Características físicas | |||
| Condición a 20 °C | firma | ||
| Punto de fusion | 660,3 °C, 1220,6 °F, 933,5 K | ||
| Punto de ebullición | 2519°C, 4566°F, 2792K | ||
| Capacidad calorífica molar | 16.443 J mol−1 k1 | ||
| estructura cristalina | cúbico centrado en las caras (fcc) | ||
| Espesor | 2,70 g/cm23 | ||
| Resistencia eléctrica | 26,5 nΩm | ||
| Propiedades atómicas | |||
| Radio atómico (sin consolidar) | 1.84 | ||
| Radio covalente | 1.24 | ||
| electronegatividad | 1,61 (escala de Pauling) | ||
| Afinidad electronica | 41.762 kJ mol−1 | ||
| Energía de ionización (kJ/mol) | 1º | 2do | 3ro |
| 577.54 | 1816.68 | 2744.78 | |
El número de oxidación general o estados del metal +1 +2 y +3. Debido a la disminución de la energía de la red al aumentar el tamaño, es probable que el aluminio tenga un Al. formularios+3 ion. Debido a la gran energía de ionización que no se compensa con una energía de red débil, generalmente alcanza el estado +3 por enlace covalente.
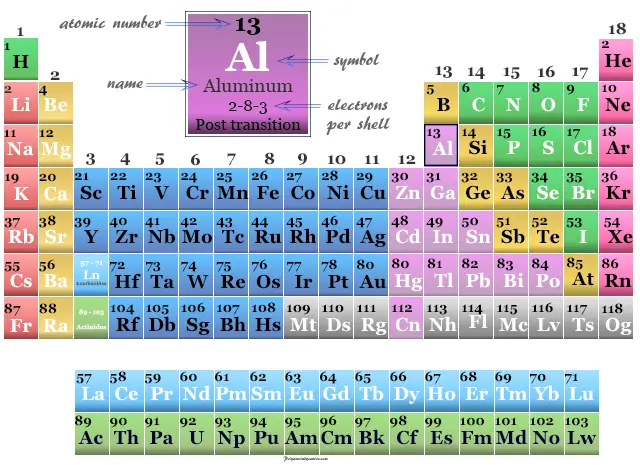
Aluminio en la tabla periódica
El aluminio se encuentra en el grupo 13 y el período 3 de la tabla periódica. Es un metaloide que se encuentra entre el boro y el galio.
 Plata, Símbolo, Propiedades, Uso, Producción, Conexiones
Plata, Símbolo, Propiedades, Uso, Producción, Conexiones¿Dónde se encuentra el aluminio?
El elemento más abundante, el aluminio, se encuentra en varios minerales de silicato como la mica, el feldespato, la caolinita y la arcilla. El único mineral de fluoruro es la criolita (Na3alF6), encontrado en Groenlandia.
Los principales minerales se encuentran en la naturaleza en forma de óxidos y óxidos hidratados anhidros. Óxido como el corindón (Al2O3) se utiliza en piedras preciosas (rubí, zafiro) debido a su dureza.
¿Dónde se encuentra la bauxita?
La principal fuente comercial de aluminio metálico es el hidroxióxido como el Al.2O3xH2Oh, o bauxita. Una muestra trabajable de bauxita contiene de 40 a 60 por ciento de alúmina metálica (Al2O3), 12 a 30 por ciento de agua, 1 a 15 por ciento de óxido de hierro (Fe2O3), y 3 a 4 por ciento de óxido de titanio (TiO2).
Ricos yacimientos de bauxita se encuentran en Australia, Brasil, Guinea, Jamaica, Francia, Estados Unidos, Rusia, India y varias provincias africanas.
¿Quién descubrió el aluminio?
El alumbre era el compuesto de aluminio que se usaba mucho en Roma para la producción de varios tipos de medicamentos y tintes en textiles.
El químico británico Sir Humphry Davy no pudo aislar el metal, pero sugirió el nombre del elemento aluminio o aluminio.
En 1825 el físico danés Hans Christian Orsted descubrió el metal por primera vez mezclando cloruro de aluminio (AlCl3) con amalgama de potasio. La producción comercial del elemento comenzó en 1954 por electrólisis de NaAlCl.4.
Proceso de producción de aluminio.
Se puede producir electrolíticamente a partir de bauxita en celdas electroquímicas.
La bauxita purificada (pf 2050°C) se disuelve en criolita y se electroliza a 950°C en celdas de acero revestidas de carbono.
Una mezcla de criolita, CaF2alF3Ali2O3li2CO3 se utiliza en el electrolito porque tiene un punto de fusión más bajo, permite un mayor flujo de corriente y reduce la emisión de flúor.
La reacción del electrodo para la producción de aluminio,
Cátodo: 2 Al+3 + 6º → 2 Al
ánodo: 3 O−2 → 3 O + 6e
El aluminio fundido se hunde hasta el fondo de la celda y se descarga. La superficie del electrolito se cubrió con una capa de coque, que oxidó el oxígeno en evolución para proteger los valiosos electrodos.
Propiedades químicas
Debido a la presencia de una capa protectora, no se ve afectado por el agua. Si la película se elimina por amalgamación, se formará agua. [Al(OH)3 + H2]. Todos los elementos del Grupo 13 tienen diferentes propiedades químicas y reactividad.
- Por ejemplo, Al y Ga se disuelven en ácido clorhídrico acuoso para dar M+3 iones, pero no Tl debido a la inestabilidad de TlCl.
- Al apenas se ve afectado por el ácido sulfúrico diluido, pero el ácido concentrado se reduce a dióxido de azufre.
- El ácido nítrico diluido y concentrado hace que el aluminio sea pasivo al formar una capa protectora de óxido. Al se disuelve en álcali acuoso caliente (litio, sodio y potasio) para formar [Al(OH)4] e hidrógeno.
Ingredientes químicos
La estructura electrónica de Al sugirió que forma principalmente compuestos químicos trivalentes. Los compuestos de aluminio en el estado +3 son dominantes por enlace químico covalente. En condiciones adecuadas formaron compuestos +2 y +1 como AlCl, Al2Ah, y AlO.
Al aprender química, el ión triple (Al+3) los iones se pueden estabilizar en soluciones acuosas mediante una fuerte energía de hidratación, generalmente seis moléculas de agua fuertemente retenidas por el Al+3 ion.
Hidruro de aluminio
El hidruro de Al es un sólido incoloro no volátil, térmicamente inestable por encima de 150-200 ° C. Es un agente reductor fuerte y aductos con bases de Lewis fuertes.
El tetrahidrocomplejo de Al como LiAlH4 es un compuesto químico muy importante ampliamente utilizado en química orgánica o en la reducción de hidrocarburos.
Haluros de aluminio
Los cuatro trihaluros de aluminio tienen la fórmula general AlX3, donde X = flúor, cloro, bromo y yodo. Todos los compuestos se pueden preparar mediante una combinación directa del metal con haluros.
Las propiedades de los trihaluros son muy amplias. Por ejemplo, el fluoruro es un sólido cristalino iónico.
¿Qué es el óxido de aluminio?
La alúmina es un importante compuesto químico del aluminio con dos formas estructurales, α-Al2O3 y ϒ-Ali2O3.
El α-Ali2O3 ocurre en la naturaleza como corindón que es resistente al agua y a los ácidos y se usa en piedras preciosas.
La γ-alúmina es deformada, menos densa y blanda con una alta tensión superficial en forma líquida. Estas propiedades de la -alúmina son excelentes reactivos para la deshidratación, decoloración y absorción del cronógrafo.
La β-alúmina ahora se está desarrollando como un conductor de iones de cerámica útil para baterías de alta energía. Grandes cantidades de óxido de aluminio se utilizan para la producción comercial de aluminio.
Uso de aluminio
El aluminio ha adquirido una alta posición entre los metales en los últimos años debido a sus diversas propiedades exclusivas,
- es fácilmente maleable y no tóxico;
- bastante resistente a la corrosión en condiciones secas
- buenos conductores térmicos y eléctricos.
- es barato en precio
Las propiedades anticorrosivas se deben a la capa protectora de óxido del metal. El aluminio puro es bastante blando y débil, pero la forma comercial contiene pequeñas cantidades de silicio y el carbono es duro y fuerte.
La resistencia mecánica del aluminio aumenta significativamente al alearse con metales como el hierro, el cobre, el manganeso, el silicio, el magnesio o el zinc. Las aleaciones de aluminio se utilizan en la construcción, el transporte, los envases y embalajes, las líneas eléctricas, la maquinaria y la industria de la pintura.
- El metal y sus aleaciones ahora se usan ampliamente en aeronaves, combustibles para cohetes, camiones, remolques y armazones de automóviles.
- También lo hemos utilizado en la fabricación de ventanas, puertas y paneles de construcción.
- Cuando se fabriquen máquinas, utensilios y otros productos domésticos, incluidos muebles, también de aleación de aluminio.
El aluminio es un elemento químico que se encuentra en la tabla periódica con el símbolo Al y el número atómico 13. Es uno de los metales más abundantes en la corteza terrestre y se utiliza ampliamente en diversas aplicaciones debido a sus propiedades únicas.
En la tabla periódica, el aluminio se encuentra en el grupo 13 y en el periodo 3. Es un metal ligero y resistente, lo que lo hace ideal para su uso en la fabricación de una amplia variedad de productos. Además, tiene un bajo punto de fusión, lo que facilita su moldeo y conformado en diferentes formas.
El aluminio es uno de los elementos más versátiles y ampliamente utilizados en la industria moderna. Se utiliza en la fabricación de aviones, automóviles, envases de alimentos, edificios, cables eléctricos y muchos otros productos. Esto se debe a su alta conductividad térmica y eléctrica, su resistencia a la corrosión y su capacidad para formar aleaciones con otros metales.
El descubrimiento del aluminio se atribuye al químico danés Hans Christian Ørsted en 1825. Sin embargo, su producción a gran escala no fue posible hasta mediados del siglo XIX, cuando se desarrollaron métodos más eficientes para extraerlo de su mineral de origen, la bauxita. Desde entonces, la producción de aluminio ha aumentado significativamente debido a su creciente demanda en diversas industrias.
En resumen, el aluminio es un elemento químico representado en la tabla periódica como Al. Es un metal ligero, resistente y altamente versátil que se utiliza en numerosas aplicaciones industriales. Su descubrimiento y producción a gran escala han permitido su uso generalizado en la fabricación de una amplia gama de productos. El aluminio es un material clave en la sociedad moderna y su presencia en la tabla periódica es una prueba de su importancia en la industria y la tecnología.