¿Qué es el silicio?
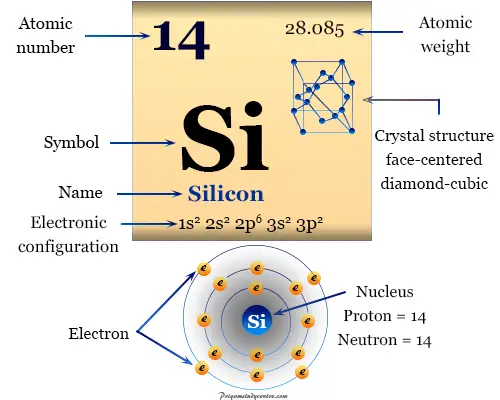
Silicio es un importante metaloide o elemento químico en la familia del carbono o grupo 14 de la tabla periódica con número atómico 14 y símbolo Si. Se utiliza como los principales materiales de construcción de nuestra civilización en forma de piedras, arena y arcilla.
![]()
El silicio es el segundo elemento más abundante después del oxígeno en la corteza terrestre.
Lectura relacionada: Sodio, Símbolo, Propiedades, Hechos, Uso, Compuestos
Sodio, Símbolo, Propiedades, Hechos, Uso, CompuestosPropiedades del silicio
Forma una red cristalina cúbica tipo diamante centrada en las caras. Debido a su mayor tamaño y energía de enlace más débil, el punto de medición del elemento es más bajo que el del carbono.
Las tendencias de las propiedades de los elementos del grupo 14 se pueden entender en gran medida a partir de la configuración electrónica de la capa de valencia.
Algunas propiedades atómicas y físicas importantes del silicio se resumen debajo de la tabla,
Lectura relacionada: Berilio, Símbolo, Propiedades, Hechos, Conexiones, Uso
Berilio, Símbolo, Propiedades, Hechos, Conexiones, Uso| Silicio |
|||
| Símbolo | Si | ||
| Descubrimiento | Jons Jacob Berzelius en 1824 | ||
| Nombre derivado de | La palabra latina silex' o silicis significa pedernal | ||
| alótropos | Si amorfo, Si cristalino | ||
| isótopos comunes | 14Si28, 14Si30 | ||
| número de oxidación o estados | 4, −4 | ||
| número CAS | 7440-21-3 | ||
| Propiedades periódicas | |||
| número atómico | 14 | ||
| Peso atomico | 28,085 | ||
| electrón por celda | 2, 8, 4 | ||
| Configuración electrónica | [Ne] 3s2 3p2 | ||
| Bloquear | bloque p | ||
| Grupo | 14 | ||
| Período de tiempo | 3 | ||
| Características físicas | |||
| Condición a 20 °C | firma | ||
| Punto de fusion | 1414°C, 2577°F | ||
| Punto de ebullición | 3265 °C, 5909 °F | ||
| Capacidad calorífica molar | 19,789 J mol−1 k1 | ||
| estructura cristalina | diamante cúbico centrado en la cara | ||
| Espesor | 2,3290 g/cm3 | ||
| Propiedades atómicas | |||
| Radio atómico (sin consolidar) | 2.10 | ||
| Radio covalente | 1.14 | ||
| Electronegatividad | 1,90 (escala de Pauling) | ||
| Afinidad electronica | 134,07 kJ mol−1 | ||
| Energía de ionización (kJ/mol) | 1º | 2do | 3ro |
| 786.51 | 1577.13 | 3231.58 | |
Silicio en la tabla periódica
La química y la posición en la tabla periódica del silicio son seguidas por su configuración electrónica.
![]()
 Niquel, Símbolo, Propiedades, Producción, Hechos, Uso
Niquel, Símbolo, Propiedades, Producción, Hechos, UsoLa configuración electrónica exterior del elemento es s2pags2. Tiene cuatro electrones en la capa cuántica exterior. Por lo tanto, el silicio es un metaloide típico del grupo 14 (IVA) de la tabla periódica.
¿Dónde se encuentra el silicio?
El silicio es el segundo elemento más abundante después del oxígeno, que se encuentra en un 27,6 por ciento en la corteza terrestre, pero no se encuentra libremente en la naturaleza. Tiene una alta afinidad por el oxígeno y forma el SiO estable4 unidad que se combina con otra para formar una variedad de silicatos.
La sílice y los silicatos son comunes en arena, arcilla y varios minerales de silicato.
Proceso de producción
Es producido por SiO. disminuir2 (arena) a través de coque de alta pureza en un horno de arco eléctrico
SiO2 + 2 C → Si + 2 CO
El exceso de SiO impidió la formación de SiC. usar2. El producto es casi 96 a 97 por ciento puro. Se purificó con SiCl. poner4. El compuesto SiCl4 fue purificado por destilación y reducido con magnesio y zinc para producir silicio puro.
El silicio superpuro se utiliza en la industria electrónica como semiconductor y se obtiene mediante refinado por zonas.
Datos interesantes
- Cristaliza como un diamante con una distancia de enlace Si-Si en el sólido cristalino igual a 235 µm. A muy alta presión, se puede producir una forma deformada más densa, pero la distancia de enlace Si-Si permanece prácticamente sin cambios.
- La suma de las cuatro energías de ionización es muy alta. Por lo tanto, es desfavorable lograr la configuración de gas noble al perder cuatro electrones.
- En la mayoría de los casos se logra mediante la formación de cuatro enlaces covalentes con sp3 hibridación.
- Los enlaces químicos múltiples también se forman usando el orbital 3d vacío y el orbital p lleno con átomos de oxígeno, nitrógeno o halógeno.
Compuestos de Silicio
Los compuestos de silicio son estereoquímicamente diferentes de sus análogos de carbono. Por ejemplo (SiH3)3N es plano pero (CH3)3N es tetraédrico.
El comportamiento químico y los compuestos de los elementos del Grupo-14 dominaron bajo el estado de oxidación +4.
hidruro de silicio
Todos los elementos del Grupo 14 formaron hidruros volátiles covalentes, pero la tendencia a formar disminuye en el grupo.
Debido a la fuerte tendencia de la catenación, el carbono formó una gran cantidad de compuestos de anillo y cadena o hidrocarburos como alcanos o parafina (Cnorte¿eh?2n+2), alquenos u olefinas (Cnorte¿eh?2n), acetileno (Cnorte¿eh?2n-2) y compuestos aromáticos.
El silicio formó algunos hidruros saturados o silanos con la fórmula química general Sinorte¿eh?2n+2.
Hidrólisis ácida del siliciuro de magnesio (Mg2Si) da una mezcla de SiH4Si2¿eh?6Si3¿eh?8y si4¿eh?10. Los hidruros se separan y purifican por destilación fraccionada.
¿Qué es el dióxido de silicio?
Sílice o SiO2 es el dióxido de silicio más común. Es un óxido de color amarillo debido a la presencia de óxidos de hierro (II) como el granito y la arenisca.
Muchos óxidos utilizados en las piedras preciosas son básicamente SiO hidratado.2. El cuarzo rosa (rosa), el morrión (marrón oscuro), la amatista (violeta), el citrino (amarillo) son ejemplos de este tipo de piedras preciosas.
La sílice también se encuentra en varios tipos de vegetales y organismos animales como la paja de cereales, la caña de bambú y las esponjas.
La sílice tiene diferentes tipos de estructuras macromoleculares construidas por tetraédrica SiO4 unidades conectadas compartiendo átomos de oxígeno. Las dos formas principales de sílice son el cuarzo y la cristobalita.
Tetrahaluros de silicio
Los tetrahaluros de silicio se pueden preparar por reacción directa del elemento con la molécula de halógeno.
SiF4 se prepara fácilmente con una mezcla de CaF. calentar2 y sílice en presencia de ácido sulfúrico concentrado. A diferencia de los haluros de carbono, los tetrahaluros de silicio se hidrolizan rápidamente con agua y metales alcalinos.
Los haluros como SiF4 son parcialmente hidrolizados por agua como resultado de una reacción secundaria entre HF y SiF4 al hexafluorosilicato (SiF6−2).
uso de silicio
- La mayoría de los compuestos de silicio se utilizan industrialmente sin purificarse. Más del 90 por ciento de la corteza terrestre contiene minerales de silicato, los compuestos de silicio y oxígeno.
- Muchos de estos compuestos, como la arcilla, la arena de cuarzo y la mayoría de los tipos de piedra, pueden utilizarse comercialmente en los materiales de construcción de nuestra civilización.
- Los silicatos de calcio se utilizan para fabricar cemento Portland en morteros de construcción y estuco moderno.
- El ferrosilicio se usa ampliamente para fabricar acero resistente a la corrosión.
En la industria electrónica, se utilizan pequeñas cantidades de silicio ultrapuro para fabricar semiconductores. Formó un semiconductor de tipo n cuando se dopó con elementos del grupo 15, como fósforo y arsénico, como se muestra debajo de la imagen.
![]()
Cuando el silicio se dopó con elementos del grupo 13, como el boro o el aluminio, formó un semiconductor de tipo n.
![]()
Estos semiconductores controlaban la conducción de electricidad en dispositivos electrónicos. Este tipo de semiconductores se utiliza en casi todos los dispositivos electrónicos como transistores, diodos, fotosensores, microcontroladores, chips integrados.