Elemento Nitrógeno
Nitrógeno es un elemento químico no metálico del grupo 15 de la tabla periódica con símbolo norte y fórmula química norte2. Es un gas incoloro, inodoro e insípido y una parte esencial de la materia viva. El nitrógeno es la sustancia más abundante en la atmósfera terrestre, con un 78 % en volumen y un 75 % en peso en el aire.
La abundancia de nitrógeno en las rocas y el suelo del entorno terrestre es notablemente baja (alrededor de 19 ppm), comparable con el galio, el niobio y el litio. Solo los minerales nitrogenados como el nitrato de potasio (nitrato) y el nitrato de sodio (nitrato de chile) se aíslan a través del ácido nítrico mediante la acción de bacterias nitrificantes o fijadoras de nitrógeno.
Lectura relacionada: Oxigeno, Símbolo, Propiedades, Producción, Uso, Hechos
Oxigeno, Símbolo, Propiedades, Producción, Uso, Hechos¿Quién descubrió el nitrógeno?
Carl Wilhelm Scheele y Henry Cavendish habían descubierto y aislado nitrógeno de forma independiente, pero el crédito por el descubrimiento se le dio al médico escocés Daniel Rutherford en 1772. Rutherford otorgó este honor porque su trabajo se publicó por primera vez en una revista científica.
El nombre nitrógeno fue dado en 1790 por el químico francés Jean-Antoine-Claude Chaptal. Podría derivar el nombre de la palabra griega 'nitron' y 'genes' significa formación de nitrato.
¿Dónde se encuentra el nitrógeno?
Grandes depósitos de compuestos nitrogenados como el nitrato se encuentran en Bolivia, Italia, España, Rusia y algunas regiones de la India. La principal intervención humana se produce a través de la fijación artificial de N2 por fertilizantes para satisfacer la creciente demanda de alimentos en nuestra creciente familia humana.
Lectura relacionada: Hidrogeno, Símbolo, Propiedades, Isótopos, Hechos, Uso
Hidrogeno, Símbolo, Propiedades, Isótopos, Hechos, UsoNitrógeno en la tabla periódica
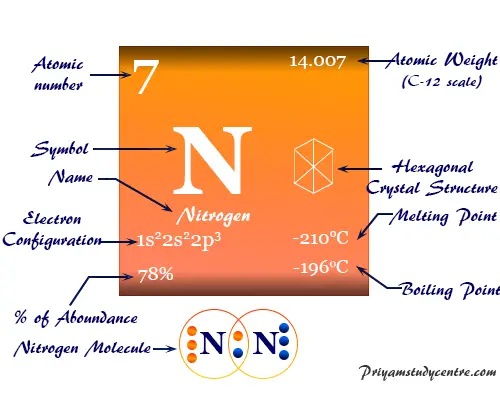
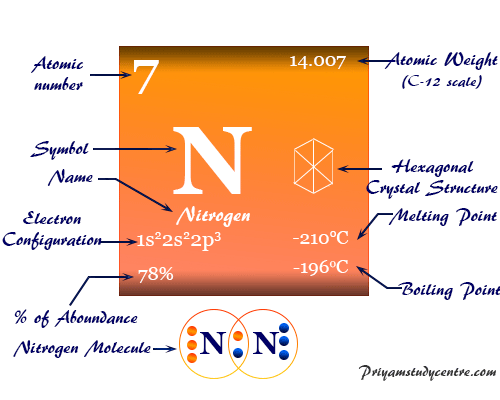
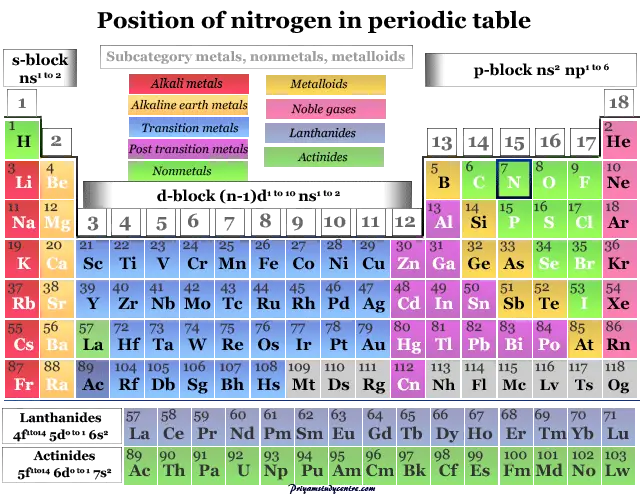
La configuración electrónica del nitrógeno es 1s.2 2s2 2p3. Por lo tanto, se ubica en el grupo 15 y período 2 de la tabla periódica.
 Rodio - metal, precio, uso
Rodio - metal, precio, usoSe coloca junto con elementos de bloque p. Los miembros del grupo de nitrógeno son fósforo, arsénico, antimonio y bismuto.
isótopos
Al aprender química, el nitrógeno natural existe principalmente en dos isótopos estables, 14N y 15N. La abundancia relativa de 14NORTE:15N≈ 272:1. El isótopo radiactivo, 7norte15 puede prepararse o separarse por una reacción de intercambio o por difusión térmica.
En 1919, el físico británico Ernest Rutherford introdujo por primera vez hechos artificiales de reacciones nucleares radiactivas mediante el bombardeo de rayos alfa en 14N isótopo para formar 17O y partículas de protones.
Propiedades del nitrógeno
| Nitrógeno |
|||
| Símbolo | norte | ||
| Descubrimiento | Daniel Rutherford en 1772 | ||
| Nombre derivado de | La palabra griega nitron y genes significan formación de nitrato. | ||
| alótropos | dinitrógeno (N2) | ||
| isótopo común | 7norte14 | ||
| estructura cristalina | Red cristalina hexagonal | ||
| Propiedades periódicas |
|||
| número atómico | 7 | ||
| electrón por escala | 2.5 | ||
| Peso atomico | 14.007 | ||
| Configuración electrónica | [He] 2s2 2p3 | ||
| Grupo | 15 | ||
| Período de tiempo | 2 | ||
| Bloquear | bloque p | ||
| Características físicas |
|||
| Condición a 20 °C | Gas | ||
| Punto de fusion | −210 °C, −346 °F, 63,2 K | ||
| Punto de ebullición | −195,79 °C, −320,43 °F, 77,35 K | ||
| Temperatura crítica | 126.21K | ||
| Espesor | 0.001145gcm−3 | ||
| Propiedades químicas |
|||
| Radio atómico (sin consolidar) | 1.55 | ||
| Radio covalente | 0.71 | ||
| número de oxidación o estados | 5, 4, 3, 2, -3 | ||
| Energía de ionización (kJ mol−1) | 1º | 2do | 3ro |
| 1402.33 | 2856.09 | 5300.47 | |
| Afinidad electronica | Desconocido | ||
| Electronegatividad | 3.04 (escala de Pauling) | ||
| Capacidad calorífica molar |
29,124 J mol−1 k−1 | ||
| número CAS | 7727-37-9 | ||
Propiedades químicas
La configuración electrónica de la capa cuántica exterior del nitrógeno es s2pags3 con dos electrones s apareados y tres electrones p no apareados. La configuración electrónica sugiere que el elemento está más cerca del siguiente gas noble que del gas noble anterior.
Es simplemente imposible asumir las configuraciones catiónicas +5 al perder los cinco electrones más externos. Por lo tanto, la mayoría de los compuestos químicos del nitrógeno son compuestos covalentes con un estado de oxidación de +3 o +5. El número de oxidación del elemento cubre un amplio rango de −3 (en NH3) a +5 (HNO3). Debido a la falta de disponibilidad de orbitales d energéticamente vacíos, no tiene espacio para la expansión de valencia.
La química del nitrógeno describe que el átomo puede lograr la siguiente configuración electrónica de gas noble al adquirir tres electrones para formar un N−3 ion (número de oxidación = −3). Sin embargo, tal unión de electrones implica un cambio de entalpía positivo alto.
La formación de iones de nitruro (N−3) requiere 2130 kJ mol−1 energía. Por lo tanto, solo se presenta en sales de nitruro de metales altamente electropositivos como el litio, berilio, magnesio, calcio, etc.
Reaccion quimica
El nitrógeno generalmente no es reactivo a temperatura ambiente por las siguientes razones:
- Tiene una alta energía de enlace N≡N.
- La descripción del orbital molecular del dinitrógeno es 1σgramo1 2σtú2 1πtú4 3σgramo2. Una gran diferencia entre el GAY (3σgramo) y LUMO (2πtú).
- Distribución simétrica de electrones. Hace que las moléculas de nitrógeno no sean polares.
Producción de nitrógeno
Producción desde el aire
Industrial o comercialmente, se obtienen grandes cantidades de dinitrógeno durante el aislamiento de oxígeno por destilación fraccionada de aire líquido. Después2 La molécula se evapora antes que el oxígeno porque su punto de ebullición es más bajo (N2: −195,8°C; O2: -183,1 °C). El producto suele contener una fracción de argón.
También se puede producir a gran escala quemando carbón o hidrocarburo en el aire. El dióxido de carbono y el agua producidos se separan de la mezcla de gases.
Preparación de laboratorio de nitrógeno
El nitrógeno se puede obtener en el laboratorio a través de una variedad de reacciones químicas. Algunos de estos procesos de fabricación se dan a continuación,
- Se prepara en el laboratorio calentando nitrato de amonio.
NUEVA HAMPSHIRE4NO2 → No2 + 2H2O
Algunos NO y HNO3 se forman por este proceso. Estos pueden eliminarse con absorbentes como el dicromato de potasio en presencia de ácido sulfúrico. - Se prepara calentando dicromato de amonio o azida de sodio.
(NUEVA HAMPSHIRE4)2cr2O7 → No2 + Cr2O3 + 4 horas2O
2 NaN3 → 2 Na+N2 - La reacción de amoníaco con agua de bromo produjo dinitrógeno en el laboratorio.
8 NH3 + 3 Hab2 → No2 + 6 NH4hermano - La reacción a alta temperatura del amoníaco con el óxido de cobre.
3 CuO + 2 NH3 → 3 Cu + N2 + 3 horas2O
¿Para qué sirve el nitrógeno?
- El nitrógeno elemental se utiliza en gran medida para proporcionar una atmósfera inerte en la metalurgia.
- También se utiliza en diversas industrias químicas como la industria siderúrgica para soldadura, soldadura fuerte, soldadura fuerte y la industria petroquímica.
- En la industria química, el nitrógeno se usa ampliamente para producir amoníaco y cianamida de calcio.
- Es un producto químico útil para la investigación criogénica.
- El dinitrógeno se utiliza como inhibidor en caso de incendio o explosión.
Uso de nitrógeno líquido
- El nitrógeno líquido se utiliza en operaciones a baja temperatura.
- También usamos dinitrógeno al moler cauchos y materiales similares al caucho.
- El nitrógeno líquido también se utiliza para la conservación de muestras biológicas.
- En medicina, el nitrógeno líquido se utiliza como refrigerante de congelación rápida para preservar la sangre, la médula ósea, los tejidos, las bacterias y los espermatozoides.
¿Qué es el ciclo del nitrógeno?
El nitrógeno es un elemento esencial para el crecimiento de la vida vegetal y animal en la naturaleza. Alterna constantemente entre la atmósfera y la biosfera. Para equilibrar el ciclo del nitrógeno en la naturaleza, este regresa a la atmósfera a través de los siguientes pasos clave:
- El efecto de las bacterias fijadoras de nitrógeno
- Fijación artificial de dinitrógeno
- Iluminación en la atmósfera superior
- Muerte y descomposición de plantas y animales.
- Combustión de madera, carbón y petróleo.
- Drenaje de aguas superficiales
Fijación de nitrógeno por bacterias.
Alrededor del 60 por ciento de N2 se introduce en el suelo por la acción de bacterias nitrificantes (Rhizobium, Anabaena, Nostoc, Azotobactor y Clostridium pastorium). Estas bacterias nitrificantes convierten el dinitrógeno directamente en nitratos o sales de amonio.
Rhizobium es la bacteria más importante de esta categoría. Vive simbióticamente en los nódulos o raíces de ciertas plantas como legumbres, guisantes, habas, etc.
La enzima fijadora de nitrógeno nitrogenasa en nitrógeno sólido en el suelo. La fijación es entonces mayor que la fijación artificial por el proceso de Haber (150 millones de toneladas frente a 120 millones de toneladas).
fijación industrial
La fijación industrial se utiliza para cultivar nitrógeno en el suelo para producir grandes cantidades de alimentos para la población mundial en constante aumento. El procedimiento principal implica el proceso Haber para la producción de amoníaco que convierte el ácido nítrico y otros fertilizantes.
Otros procesos para fijar nitrógeno
- La iluminación en la atmósfera superior conduce a la formación de NO y NO2llevado al fondo por la lluvia de ácido nítrico.
- La mayor parte del nitrógeno regresa al suelo a través de la muerte o descomposición de plantas y animales.
- La combustión de madera, carbón y petróleo produce una pequeña cantidad de NO. libre2 en la atmósfera.
- La escorrentía del agua superficial lleva algo de gas nitrógeno al mar, que se utiliza para sustentar la vida marina común.